2021-2022學年山東省濰坊市(安丘市、諸城市、高密市)高二(上)期中化學試卷
發布:2024/11/9 12:0:2
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題目要求。
-
1.化學與生產、生活密切相關。下列做法或說法錯誤的是( )
A.將煤氣中毒患者移至空氣流通處進行救治 B.醫用藥品常在低溫、干燥的環境中密封保存 C.農業生產中草木灰和銨態氮肥混合使用以增加肥效 D.NH4Cl和ZnCl2溶液可作為焊接除銹劑 組卷:8引用:3難度:0.7 -
2.煤氣化過程中的主要反應:C(s)+H2O(g)?CO(g)+H2(g)ΔH>0,在恒溫恒容密閉體系中進行反應,可作為判斷反應是否達到平衡狀態的依據是( )
A.c(H2O)=c(CO) B.容器內氣體密度不變 C.v(CO):v(H2)=1:1 D.消耗1mol C同時生成1mol H2 組卷:25引用:3難度:0.7 -
3.以粗銅和純銅作電極,硫酸銅溶液為電解質溶液電解精煉銅。下列敘述錯誤的是( )
A.與電源正極相連的是粗銅 B.陰極發生反應:Cu2++2e-═Cu C.通電過程中,溶液中SO42-向發生氧化反應的電極移動 D.通電一段時間,電解質溶液中c(Cu2+)不變 組卷:27引用:2難度:0.7 -
4.學習小組對可逆反應FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)ΔH<0進行探究。常溫下,向盛有2mL0.01mol?L-1FeCl3溶液的試管中滴加2滴0.01mol?L-1KSCN溶液,改變下列條件,試管中溶液顏色不會加深的是( )
A.將試管放入冰水浴中 B.加水稀釋 C.加入1mol?L-1KSCN溶液 D.加入少量FeCl3固體 組卷:10引用:1難度:0.5 -
5.《科學》雜志評出“十大科技突破”,其中“火星上‘找’到水的影子”名列第一。下列關于水的說法正確的是( )
A.升高溫度,測得水的pH<7,顯酸性 B.向水中加入FeSO4固體,水的電離平衡向正反應方向移動,Kw增大 C.Zn和稀硫酸制取氫氣過程中,溶液中水的電離平衡向正反應方向移動 D.25℃時,pH相同的氨水和純堿溶液中水的電離程度相同 組卷:58引用:4難度:0.7 -
6.根據下列實驗操作和現象,得到的結論正確的是( )
選項 實驗操作 現象 結論 A 室溫下,向硅酸鈉溶液中通入二氧化硫 溶液變渾濁 硫酸的酸性比硅酸酸性強 B 向濃度均為0.1mol?L-1的BaCl2和CaCl2混合溶液中加入Na2SO4溶液 混合溶液中出現白色沉淀 Ksp(BaSO4)>Ksp(CaSO4) C 溶液向FeCl3溶液中滴加NaOH溶液 產生紅褐色沉淀 制得Fe(OH)3膠體 D 向0.1mol?L-1Na2SO3溶液和0.1mol?L-1NaHSO3溶液中分別加入石蕊試液 Na2SO3溶液變藍,NaHSO3溶液變紅 SO32-結合H+的能力比HSO3-的強 A.A B.B C.C D.D 組卷:9引用:1難度:0.7
三、非選擇題:本題共5小題,共60分。
-
19.亞硫酸鈉在印染、造紙等領域應用廣泛。利用工業廢堿渣(主要成分Na2CO3)吸收硫酸廠尾氣中的SO2制備無水Na2SO3的流程如圖:

回答下列問題:
(1)常溫下,Na2CO3溶液顯堿性的理由是(用離子方程式回答);其溶液中:c(Na+)12c()(填“>”“<”或“=”)。CO2-3
(2)“母液”溶質中的鹽主要是(填化學式),常溫下該物質的稀溶液中陰離子濃度由大到小的順序為。
(3)常溫下,向某濃度的亞硫酸溶液中緩慢加入Na2CO3粉末也能制得Na2SO3,測得反應過程中溶液的pH與離子濃度的關系如圖所示。
①表示pH與lg的變化關系的曲線是c(SO2-3)c(HSO-3)(填“Ⅰ”或“Ⅱ”)。
②H2SO3的Ka1=。組卷:6引用:3難度:0.5 -
20.金礦提金時,用NaCN溶液浸取金生成Na[Au(CN)2],再用鋅置換出金,產生的含氰廢水、廢氣需處理后排放。
已知:氫氰酸(HCN)有劇毒,易揮發,25℃時Ka(HCN)=6.25×10-10。
回答下列問題:
(1)[Au(CN)2]-存在著兩步電離平衡,其第二步電離方程式為。
(2)配制NaCN溶液時,將NaCN固體溶于NaOH溶液中,再用蒸餾水稀釋配成溶液。原因是(用離子方程式表示)。
(3)Cu2+可做H2O2氧化廢水中CN-的催化劑,氧化過程中總氰化物(CN-、HCN等)去除率隨溶液初始pH變化如圖1所示。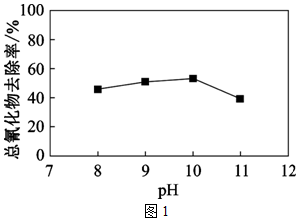
①在酸性條件下,H2O2也能氧化CN-但實際處理廢水時卻不在酸性條件下進行的原因是。
②當溶液初始pH>10時,總氰化物去除率下降的原因可能是。
(4)利用反應HCN(g)+H2O(g)NH3(g)+CO(g)ΔH>0處理廢氣中HCN。將物質的量均為1mol的HCN和H2O混合氣體通入密閉容器中發生反應,HCN的去除率隨溫度的變化曲線如圖2所示。處理HCN時最適宜的溫度為催化劑,此溫度下反應進行10min達平衡,該反應的Kx=。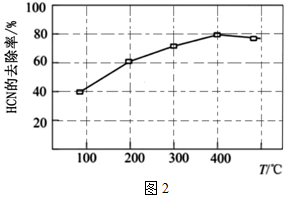 組卷:6引用:1難度:0.7
組卷:6引用:1難度:0.7


