2020-2021學年四川省高二(下)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(在下列給出的選項中只有一個選項符合題意。有16個小題,每小題3分,共48分)
-
1.元素化學性質隨著原子序數的遞增呈現周期性變化的原因是( )
A.原子半徑的周期性變化 B.電負性的周期性變化 C.第一電離能的周期性變化 D.原子核外電子排布的周期性變化 組卷:20引用:3難度:0.9 -
2.電子由3d能級躍遷至4p能級時,可通過光譜儀直接攝取( )
A.電子的運動軌跡圖象 B.原子的吸收光譜 C.電子體積大小的圖象 D.原子的發射光譜 組卷:360引用:22難度:0.7 -
3.下列無機含氧酸分子中酸性最強的是( )
A.HNO2 B.H2SO3 C.HClO3 D.HClO4 組卷:120引用:15難度:0.5 -
4.類推的思維方法在化學學習與研究中可能會產生錯誤的結論,因此類推出的結論需經過實踐的檢驗才能確定其正確與否。下列幾種類推結論正確的是( )
A.從CH4、NH4+、SO42-為正四面體結構,可推測PH4+、PO43-也為正四面體結構 B.H2O常溫下為液態,H2S常溫下也為液態 C.金剛石中C-C鍵的鍵長為154.45pm,C60中C-C鍵的鍵長為140~145pm,所以C60的熔點高于金剛石 D.CO2與SiO2化學式相似,可推測出CO2與SiO2的結構也相似 組卷:5引用:3難度:0.7 -
5.下列物質呈固態時,一定屬于分子晶體的是( )
A.非金屬單質 B.非金屬氧化物 C.含氧酸 D.金屬氧化物 組卷:117引用:6難度:0.7 -
6.下列物質的變化過程中,化學鍵沒有被破壞的是( )
A.碘升華 B.氯化鈉受熱熔化 C.金屬汞汽化 D.氯化氫溶于水 組卷:21引用:2難度:0.7
二、填空題(共52分)
-
19.許多元素及它們的化合物在科學研究和工業生產中具有許多用途,請回答下列有關問題:
(1)某同學畫出基態碳原子的核外電子排布圖: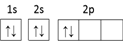 ,該電子排布圖違背了 ;、-CH3、CH+3都是重要的有機反應中間體,CH-3的VSEPR模型為CH-3。
,該電子排布圖違背了 ;、-CH3、CH+3都是重要的有機反應中間體,CH-3的VSEPR模型為CH-3。
(2)CH4中共用電子對偏向C,SiH4中共用電子對偏向H,則C、Si、H的電負性由大到小的順序為。
(3)基態溴原子的價層電子排布圖為,用價層電子對互斥理論推斷SnBr2分子中Sn-Br的鍵角120°(填“>”、“<”或“=”)。
(4)CN-能與多種金屬離子形成配合物,例如,工業冶煉金的原理:2[Au(CN)2]-+Zn═2Au+[Zn(CN)4]2-。與CN-互為等電子體的分子有(只寫一種),1mol[Zn(CN)4]2-中含molσ鍵。
(5)類鹵素(SCN)2對應的酸有兩種,理論上硫氰酸(H-S-C≡N)的沸點低于異硫氰酸(H-N=C=S)的沸點,其原因是。組卷:3引用:3難度:0.7 -
20.中國科學技術大學俞書宏教授團隊和高敏銳教授課題組通過室溫過飽和溶液共沉積法,實現了無定形NiFeMo氧化物納米材料的宏量制備,該方法簡便快捷,反應幾分鐘即可一次性生產多達515克的產物,制備的無定形NiFeMo氧化物在堿性條件下展示出優異的OER催化活性,明顯優于結晶型NiFeMo氧化物。根據所學知識回答下列問題:
(1)區別結晶型NiFeMo氧化物和無定形NiFeMo氧化物最可靠的科學方法為,結晶型NiFeMo氧化物能自發呈現多面體外形,這種性質稱為晶體的。
(2)Mo為第五周期元素與Cr同族,則Mo的價層電子排布式為。
(3)配合物Ni(CO)4常溫下為液態,易溶于CCl4,苯等有機溶劑,是獲得高純度納米鎳的原料,Ni(CO)4是(填“極性”或“非極性”)分子。
(4)下列狀態的鐵中,電離最外層的一個電子所需能量最大的是(填編號)。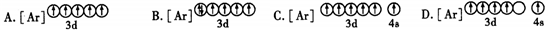
(5)FeCl3中的化學鍵具有明顯的共價性,蒸氣狀態下以雙聚分子存在的FeCl3的結構式為,其中Fe的配位數為。
(6)立方NiO(氧化鎳)晶體的結構如圖所示,其晶胞邊長為a pm,列式表示NiO晶體的密度為g/cm3(不必計算出結果,阿伏加德羅常數的值為NA)。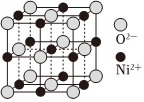 組卷:18引用:4難度:0.4
組卷:18引用:4難度:0.4


