2017-2018學年陜西省西安鐵一中高二(上)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題21小題,每小題2分,共42分.每小題只有一個選項符合題意)
-
1.《本草衍義》中對精制砒霜過程有如下敘述:“取砒之法,將生砒就置火上,以器覆之,令砒煙上飛著覆器,遂凝結累然下垂如乳,尖長者為勝,平短者次之。”文中涉及的操作方法是( )
A.蒸餾 B.升華 C.干餾 D.萃取 組卷:2298引用:46難度:0.9 -
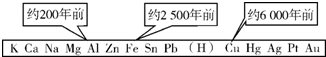 2.從石器、青銅器到鐵器時代,金屬的冶煉體現了人類文明的發展水平.如圖表示了三種金屬被人類開發利用的大致年限,金屬被利用年限的先后主要取決于( )
2.從石器、青銅器到鐵器時代,金屬的冶煉體現了人類文明的發展水平.如圖表示了三種金屬被人類開發利用的大致年限,金屬被利用年限的先后主要取決于( )A.金屬的導電性強弱 B.金屬在地殼中的含量多少 C.金屬的化合價高低 D.金屬的活動性強弱 組卷:56引用:5難度:0.9 -
3.定向爆破建筑物時,應同時切斷鋼筋和炸碎水泥,除適宜的炸藥外,還需用( )
A.氧炔焰 B.鋁熱劑 C.液氯 D.電弧 組卷:61引用:4難度:0.5 -
4.下列有關化學用語表示正確的是( )
A.中子數為16的磷原子: P3115B.氟原子的結構示意圖: 
C.CaCl2的電子式: 
D.明礬的化學式:Al2(SO4)3 組卷:222引用:8難度:0.8 -
5.合成氨所需的氫氣可用煤和水作原料經多步反應制得,其中的一步反應為:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反應達到平衡后,為提高CO的轉化率,下列措施中正確的是( )催化劑A.增加壓強 B.降低溫度 C.增大CO的濃度 D.更換催化劑 組卷:990引用:90難度:0.9 -
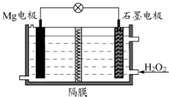 6.Mg-H2O2電池可用于驅動無人駕駛的潛航器.該電池以海水為電解質溶液,示意圖如下.該電池工作時,下列說法正確的是( )
6.Mg-H2O2電池可用于驅動無人駕駛的潛航器.該電池以海水為電解質溶液,示意圖如下.該電池工作時,下列說法正確的是( )A.Mg電極是該電池的正極 B.H2O2在石墨電極上發生氧化反應 C.石墨電極附近溶液的OH-的物質的量濃度增大 D.溶液中Cl-向正極移動 組卷:458引用:58難度:0.7 -
7.升高溫度,下列數據不一定增大的是( )
A.化學反應速率v B.水的離子積常數KW C.化學平衡常數K D.醋酸的電離平衡常數Ksp 組卷:10引用:3難度:0.7 -
8.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.無色透明的溶液中:Fe3+、Mg2+、SCN-、Cl- B.c(H+)/c(OH-)=1×10-12的溶液中:K+、Na+、 、CO2-3NO-3C.c(Fe2+)=1mol?L-1的溶液中:K+、 、NH+4、MnO-4SO2-4D.能使紫色石蕊試劑變紅的溶液中:Na+、 、NH+4、SO2-4HCO-3組卷:31引用:7難度:0.9 -
9.海洋是非常巨大的資源寶庫,以下有關海洋資源開發和利用的說法,不正確的有( )
A.海洋約占地球表面積的71%,水儲量達1.3×109億噸,故人類不存在缺水問題 B.海水資源的利用包括水資源的利用和化學資源的利用,兩者可以綜合進行 C.海水中除H2O外,還含有Cl、Na、K、Mg、Ca、S、F等多種元素的化學資源 D.由于與巖石、大氣和生物相互作用,海水中溶解和懸浮有大量無機物和有機物 組卷:26引用:5難度:0.9
二、填空題(每空2分,共58分)
-
27.鋁是應用廣泛的金屬。以鋁土礦(主要成分為Al2O3,含SiO3,含SiO3和Fe2O3等雜質)為原料制備鋁的一種工藝流程如圖:
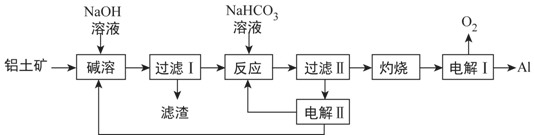
注:SiO3在“堿溶”時轉化為鋁硅酸沉淀。
(1)“堿溶”時生成偏鋁酸鈉的離子方程式為。
(2)向“過濾Ⅰ”所得濾液中加入NaHCO3溶液,溶液的pH(填“增大”、“不變”或“減小”)。
(3)“電解Ⅰ”是電解熔融Al2O3,電解過程中作陽極的石墨易消耗,原因是。
(4)“電解Ⅱ”是電解Na2CO3溶液,原理如圖所示。陽極的電極反應式為,陰極產生的物質A的化學式為。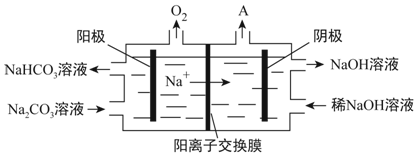
(5)茫茫黑液中,航標燈為航海員指明了方向。航標燈的電源必須長效、穩定。我國科技工作者研制出以鋁合金、Pt-Fe合金網為電極材料的海水電池。有關這種電池下列說法正確的是。
①鋁合金是陽極②鋁合金是負極③海水是電解液④鋁合金電極發生還原反應。組卷:4引用:1難度:0.5 -
28.H2S是中學化學常見物質,是重要的基本化工原料。
(1)25℃,在0.10mol?L-1H2S溶液中,通入HCl氣體或加入NaOH固體以調節溶液pH,溶液pH與c(S2-)關系如圖1(忽略溶液體積的變化、H2S的揮發)。
①pH=13時,溶液中的c(H2S)+c(HS-)=mol?L-1。
②某溶液含0.020mol?L-1Mn2+、0.10mol?L-1H2S,當溶液pH=時,Mn2+開始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(2)利用H2S廢氣制取氫氣來的方法有多種
①高溫熱分解法
已知:H2S(g)=H2(g)+S2(g)12
在恒溫密閉容器中,控制不同溫度進行H2S分解實驗。以H2S起始濃度均為cmol?L-1測定H2S的轉化率,結果見圖2.圖中a為H2S的平衡轉化率與溫度關系曲線,b曲線表示不同溫度下反應經過相同時間且未達到化學平衡時H2S的轉化率。據圖計算985℃時H2S按上述反應分解的平衡常數K=;說明溫度的升高,曲線b向曲線a逼近的原因:。
②電化學法
該法制氫過程的示意圖3如下。反應池中反應物的流向采用氣、液逆流方式,其目的是;反應后的溶液進入電解池,電解總反應的離子方程式為。組卷:6引用:1難度:0.6


