2022-2023學年黑龍江省大慶六十九中九年級(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(每題2分,共50分)
-
1.鹽酸、硫酸、氫氧化鈉、氫氧化鈣是是初中化學中的常見物質,下列關于這幾種物質的說法正確的是( )
A.濃硫酸是無色、粘稠、油狀液體,有很強的揮發性 B.氫氧化鈣的俗名是生石灰、熟石灰、消石灰 C.鹽酸是胃酸的主要成分,可用于除銹和幫助消化食物 D.氫氧化鈉固體在空氣極易潮解,溶于水溫度降低 組卷:380引用:4難度:0.6 -
2.生活中處處有化學,下列物質與其用途不一致的是( )
A.燒堿——爐具清潔劑的主要成分 B.熟石灰——秋冬季節樹干上粉刷的石灰漿 C.氫氧化鈉——改良酸性土壤 D.硫酸——金屬除銹、精煉石油 組卷:397引用:1難度:0.6 -
3.下列實驗操作或記錄正確的是( )
A.稀釋濃硫酸時,將水沿燒杯壁慢慢倒入濃硫酸中,并用玻璃棒不斷攪拌 B.測溶液pH值時,將待測液傾倒在pH試紙上,將pH試紙的顏色與標準比色卡比較即可 C.用托盤天平稱取5.4g氯化鈉 D.打開裝有濃鹽酸的試劑瓶,可看到白煙 組卷:41引用:39難度:0.7 -
4.豬肉在人們的日常飲食中一直承擔有重要作用,其新鮮度可通過測定pH判定。由右表可知:新鮮豬肉在變質過程中酸性強弱變化是( )
名稱 新鮮肉 次鮮肉 變質肉 pH 5.8~6.2 6.3~6.6 >6.7 A.變強 B.變弱 C.保持不變 D.無法確定 組卷:111引用:3難度:0.7 -
5.推理是化學學習中常用的思維方法。下列推理正確的是( )
A.CO2與NaOH反應生成鹽和水,所以能與堿反應生成鹽和水的一定是氧化物 B.堿的溶液使無色酚酞變紅,所以能使無色變紅的一定是堿的溶液 C.氫氧化銅和氫氧化鈉都含有氫氧根離子,故它們都能使無色酚酞試液變紅色 D.碳酸鹽與鹽酸反應放出氣體,但與鹽酸反應放出氣體的物質不一定是碳酸鹽 組卷:206引用:1難度:0.6 -
6.將10g質量分數為5%的稀鹽酸與50g質量分數為1%的氫氧化鋇溶液充分混合反應后過濾,得到的濾液不能與下列物質反應的是( )
A.CuCl2溶液 B.AgNO3溶液 C.MgO D.稀硫酸 組卷:219引用:6難度:0.5 -
 7.某實驗小組用如圖裝置進行微型實驗。按下列表中選項加入試劑,實驗時滴入甲,浸有丙的棉花不變紅的是( )
7.某實驗小組用如圖裝置進行微型實驗。按下列表中選項加入試劑,實驗時滴入甲,浸有丙的棉花不變紅的是( )選項 A B C D 甲 濃氨水 濃硫酸 稀鹽酸 濃鹽酸 乙 \ 水 石灰石 鋅粒 丙 無色酚酞溶液 無色酚酞溶液 紫色石蕊溶液 紫色石蕊溶液 A.A B.B C.C D.D 組卷:251引用:5難度:0.5 -
8.化學中也有“加法”,下列“加法”正確的是( )
A.10g硫酸溶液與10g氫氧化鋇溶液完全反應得到20g溶液 B.30g硫粉和30g氧氣充分反應剛好得到60g二氧化硫 C.pH=3的稀鹽酸與pH=4的稀鹽酸等體積混合得到pH=7的溶液 D.20℃時,20g的氯化鈉固體加入20g氯化鈉飽和溶液中得到40g溶液 組卷:111引用:6難度:0.6 -
9.小金完成了圖示實驗①②③,下列判斷正確的是( )
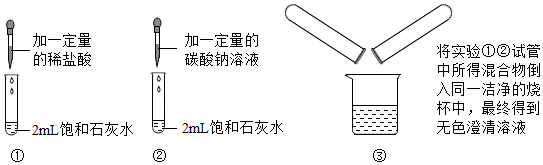
A.實驗①中石灰水有剩余 B.實驗②中有氣泡產生 C.實驗③中沒有明顯現象 D.實驗③所得溶液一定不呈堿性 組卷:680引用:5難度:0.5 -
10.在①氧化鐵②金屬鋅③氫氧化銅④氯化銅溶液四種物質中,跟稀硫酸、稀鹽酸都能發生反應且反應中表現了“酸的通性”的組合是( )
A.①②③④ B.①②③ C.①③④ D.②③④ 組卷:342引用:6難度:0.6
二、填空題(42分)
-
30.某化學興趣小組利用“化學噴泉”設計了如下實驗:20℃時,用250mL圓底燒瓶收集一瓶純凈的CO2,按如圖組裝裝置。用注射器緩緩注入3mL NaOH溶液,輕輕振蕩燒瓶,打開止水夾,玻璃導管尖嘴處很快產生“噴泉”,與此同時,C、E裝置中發生連鎖反應。回答下列問題:

(1)圖中儀器X的名稱是。
(2)注入NaOH溶液后,燒瓶內發生反應的化學方程式是。
(3)“連鎖反應”后,C試管中溶液的顏色變化為;E試管中的現象為,反應的化學方程式為。
(4)實驗結束后,同學們發現圓底燒瓶中溶液呈紅色,由此認為燒瓶中一定還有NaOH剩余,你認為是否正確?,說明原因:。組卷:1293引用:7難度:0.5
三、計算題(8分)
-
 31.實驗技能訓練中,小亮同學向氧化銅和稀硫酸充分反應后的廢液中加入一定量的氫氧化鈉溶液,發現無明顯現象。小亮同學在老師的指導下對反應后的廢液進行了實驗:他分別取50g廢液,并向其中逐漸加入等濃度的氫氧化鈉溶液,三組實驗的數據與其中一組的圖象如圖:
31.實驗技能訓練中,小亮同學向氧化銅和稀硫酸充分反應后的廢液中加入一定量的氫氧化鈉溶液,發現無明顯現象。小亮同學在老師的指導下對反應后的廢液進行了實驗:他分別取50g廢液,并向其中逐漸加入等濃度的氫氧化鈉溶液,三組實驗的數據與其中一組的圖象如圖:
請根據以上信息回答下列問題:實驗組數 第一組 第二組 第三組 加入氫氧化鈉溶液質量/g 50 100 80 產生沉淀的質量/g 0.98 2.94 2.94
(1)廢液中的溶質有(填化學式)。
(2)若三組數據中,只有某一組加入的氫氧化鈉溶液與廢液恰好完全反應,則該實驗為第組,圖中a的數值為。
(3)計算廢液中硫酸銅的溶質質量分數。(寫出計算過程)組卷:55引用:1難度:0.5


