2021-2022學年江西省吉安市高二(上)期末化學試卷
發布:2024/11/10 15:30:2
一、單選題
-
1.宋應星所著《天工開物》共三卷十八篇,書中收錄有關機械、磚瓦、陶瓷,火藥硫磺等的生產技術。被外國學者譽稱為17世紀中國工藝百科全書。下列有關說法不正確的是( )
A.凡白土曰堊土,為陶家精美啟用中陶是一種傳統硅酸鹽材料 B.古人煮沸海水制取淡水,現代可通過向海水加入明礬實現海水淡化 C.每紅銅六斤,入倭鉛四斤,先后入罐熔化,冷定取出,即成黃銅中的黃銅是合金 D.凡火藥,硫為純陽,硝為純陰中硫指的是硫黃,硝指的是硝酸鉀 組卷:40引用:2難度:0.6 -
2.圖為CO2與CH4轉化為CH3COOH的反應歷程(中間體的能量關系如虛框中曲線所示)。下列結論錯誤的是( )
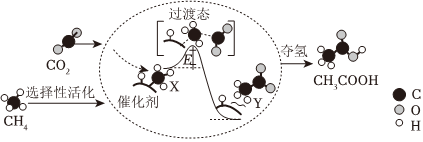
A.CO2的電子式為 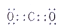
B.①→②的過程吸收能量 C.CH4分子在催化劑表面會斷開C-H鍵,斷鍵會吸收能量 D.生成乙酸的原子利用率為100% 組卷:20引用:4難度:0.7 -
3.已知熱化學方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)ΔH=akJ?mol-1。TK時,在2L恒容密閉容器中充入2molNO和2molCO,保持溫度不變,5min后反應達到平衡狀態,此時c(N2)=0.4mol?L-1。下列說法中錯誤的是( )
A.若該反應是放熱反應,則a<0 B.用NO表示的平均化學反應速率v(NO)為0.16mol?L-1?min-1 C.達到化學平衡時,CO的轉化率是80% D.保持溫度不變,若再向上述達到平衡的體系中充入2molNO 和2molCO,則反應重新達到平衡時c(N2)等于0.8mol?L-1 組卷:65引用:9難度:0.7 -
4.25℃時,下列有關溶液中粒子的物質的量濃度關系正確的是( )
A.0.1mol?L-1Na2CO3與0.lmol?L-1NaHCO3溶液等體積混合: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)23B.0.1mol?L-1Na2C2O4與0.1mol?L-1HCl溶液等體積混合(H2C2O4為二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) C.在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) D.0.jye.ai?L-1NH4Cl與0.jye.ai?L-1氨水等體積混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) 組卷:131引用:3難度:0.5 -
5.一定溫度下,向2L恒容容器中充入1molA和1molB,發生反應A(g)+B(g)=C(g)經過一段時間后達到平衡,反應過程中測定的部分數據如表.下列說法正確的是( )
t/s 0 5 15 25 35 n(A)/mol 1.0 0.85 0.81 0.80 0.80 A.前 5 s 的平均反應速率v(A)=0.03 mol?L-1?s-1 B.正反應是吸熱反應 C.保持溫度不變,起始時向容器中充入2molC,達平衡時,C的轉化率大于80% D.保持溫度不變,起始時向容器中充入0.2molA、0.2molB′和1molC,反應達到平衡前v(正)<v(逆) 組卷:20引用:2難度:0.7 -
6.下列說法正確的是( )
A.增大反應物濃度,可增大活化分子的百分數,從而使有效碰撞次數增大 B.升高溫度能使化學反應速率增大,原因是增加了反應物分子中活化分子的百分數 C.催化劑不影響反應活化能但能增大單位體積內活化分子百分數,從而增大反應速率 D.有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積),可增加活化分子的百分數,從而使反應速率增大 組卷:39引用:2難度:0.7 -
7.在體積恒定的密閉容器中,放入鎳粉并充入一定量的CO氣體,一定條件下發生反應Ni(s)+4CO(g)?Ni(CO)4(g)ΔH<0,80℃時,反應平衡常數K=2。下列說法正確的是( )
A.其他條件不變,反應達平衡時增加CO用量,平衡正向移動K值變大 B.80℃時,若不改變反應物用量且起始體積一樣的情況下,將恒容條件改成恒壓,則達平衡時CO轉化率下降 C.在80℃時,測得某時刻,Ni(CO)4、CO濃度均0.5mol/L,則此時v正<v逆 D.80℃達到平衡時,移走一部分固體鎳,平衡向逆反應方向移動 組卷:25引用:4難度:0.5
二、填空題
-
20.化學反應的能量變化是中學化學中重要組成部分,回答下列相關問題。
(1)已知:①2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)ΔH=-768.2kJ/mol;
②2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)ΔH=+116.0kJ/mol;
則Cu2S(s)+O2(g)═2Cu(s)+SO2(g)ΔH=。
(2)某同學用銅片、銀片、Cu(NO3)2溶液、AgNO3溶液、導線和鹽橋(裝有瓊脂-KNO3的U形管)設計成一個原電池,如圖1。下列判斷中正確的是。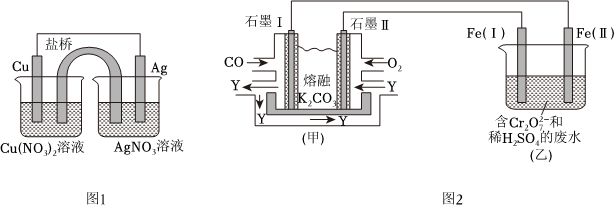
A.實驗過程中,左側燒杯變大NO-3
B.若用U形銅代替鹽橋,裝置中無電流產生
C.若用U形銅代替鹽橋則左池中電能轉化成化學能,右池中化學能轉化成電能
D.若用U形銅代替鹽橋,一段時間之后U形銅的質量減小
(3)利用電化學原理,將CO、O2和熔融K2CO3制成燃料電池,模擬工業電解法處理含Cr2的廢水,如圖2。電解過程中溶液中發生如下反應:Cr2O2-7+6Fe2++14H+═2Cr3++6Fe3++7H2O。O2-7
①甲池內陽離子向石墨移動。(填“Ⅰ”或者“Ⅱ”)。
②如圖,CO在石墨Ⅰ電極放電生成Y,Y可循環使用。甲池工作時,石墨Ⅱ附近發生的電極反應式為。
③Fe(Ⅰ)的電極反應式為。
④甲中消耗0.12mol CO,最多可以處理含Cr2O2-7mol的廢水。組卷:60引用:2難度:0.5 -
21.工業廢水中常含有一定量的Cr2
和O2-7,它們會對人類及生態系統產生很大損害,必須進行處理.常用的處理方法有兩種.方法1:還原沉淀法.該法的工藝流程為CrO2-4→①轉化H+Cr2CrO2-4→②還原Fe2+Cr3+→③沉淀OH-Cr(OH)3↓O2-7
其中第①步存在平衡:2(黃色)+2H+?Cr2CrO2-4(橙色)+H2OO2-7
(1)若平衡體系的pH=2,該溶液顯色.
(2)能說明第①步反應達平衡狀態的是.
a.Cr2和O2-7的濃度相同CrO2-4
b.2v(Cr2)=v(O2-7)CrO2-4
c.溶液的顏色不變
(3)第②步中,還原1mol Cr2離子,需要O2-7mol的FeSO4?7H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),常溫下,Cr(OH)3的溶度積Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH應調至.
方法2:電解法.
該法用Fe做電極電解含Cr2的酸性廢水,隨著電解進行,在陰極附近溶液pH升高,產生Cr(OH)3沉淀.O2-7
(5)用Fe做電極的原因為.
(6)在陰極附近溶液pH升高的原因是(用電極反應解釋).溶液中同時生成的沉淀還有.組卷:275引用:34難度:0.5


