2021-2022學(xué)年內(nèi)蒙古鄂爾多斯一中高二(上)第一次月考化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題只有一個正確答案,每小題2分,共48分)
-
1.下列物質(zhì)分類組合正確的是( )
A B C D 強(qiáng)電解質(zhì) HBr FeCl3 H3PO4 Ca(OH)2 弱電解質(zhì) HF CH3COOH BaSO4 HCl 非電解質(zhì) CCl4 Cu H2O C2H5OH A.A B.B C.C D.D 組卷:4引用:3難度:0.9 -
2.常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A.使酚酞變紅色的溶液中:Na+、Al3+、 、Cl-SO2-4B. =1×10-13mol?L-1的溶液中:Kwc(H+)、Ca2+、Cl-、NH+4NO-3C.與Al反應(yīng)能放出H2的溶液中:Fe2+、K+、 、NO-3SO2-4D.水電離的c(H+)=1×10-13mol?L-1的溶液中:K+、Na+、 、AlO-2CO2-3組卷:1002引用:54難度:0.9 -
3.下列實(shí)驗(yàn)?zāi)苓_(dá)到預(yù)期目的是( )
實(shí)驗(yàn)內(nèi)容 實(shí)驗(yàn)?zāi)康?/td> A 室溫下,用pH試紙分別測定濃度為0.1mol?L-1NaClO溶液和0.1mol?L-1CH3COONa溶液的pH 比較HClO和CH3COOH的酸性強(qiáng)弱 B 常溫下,測得飽和溶液的pH:NaA>NaB 證明常溫下的水解程度:A->B- C Ag2CO3白色懸濁液中滴加2滴Na2S稀溶液 出現(xiàn)黑色沉淀Ksp(Ag2CO3)>Ksp(Ag2S) D 在50mL酸式滴定管中裝入鹽酸,調(diào)整初始讀數(shù)為30.00mL后,將剩余鹽酸放入錐形瓶 量取20.00mL鹽酸 A.A B.B C.C D.D 組卷:6引用:2難度:0.5 -
4.下列四種溶液中,水的電離程度最大的是( )
A.pH=5的NH4Cl溶液 B.pH=5的NaHSO4溶液 C.pH=8的CH3COONa溶液 D.pH=8的NaOH溶液 組卷:475引用:16難度:0.9 -
5.水是一種極弱的電解質(zhì),在室溫下平均每n個水分子中只有1個水分子發(fā)生電離,則n值是( )
A.1×10-14 B.55.6×107 C.107 D.55.6 組卷:55引用:10難度:0.9 -
6.25℃時,關(guān)于某酸(用H2A表示)下列說法中,不正確的是( )
A.pH=a的Na2A溶液中,由水電離產(chǎn)生的c(H+)≥10?a B.將pH=a的H2A稀釋為pH=a+1的過程中, 減小,則H2A為弱酸c(H2A)c(H+)C.測NaHA溶液的pH,若pH>7,則H2A是弱酸;若pH<7,則H2A是強(qiáng)酸 D.0.2 mol?L-1H2A 溶液中的 c(H+)=a,0.1mol?L-1 H2A溶液中的 c(H+)=b,若a<2b,則H2A為弱酸 組卷:25引用:1難度:0.6 -
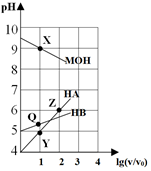 7.常溫下,把V0mL一定濃度的HA溶液、HB溶液和MOH溶液分別加水稀釋至VmL,該過程中它們的pH變化如圖所示,下列敘述正確的是( )
7.常溫下,把V0mL一定濃度的HA溶液、HB溶液和MOH溶液分別加水稀釋至VmL,該過程中它們的pH變化如圖所示,下列敘述正確的是( )A.水的電離程度:X=Y>Z B.X、Y兩點(diǎn)的溶液中:c(M+)=c(A-) C.取Q、Y兩點(diǎn)溶液同時升溫,則 增大c(A-)c(B-)D.若X、Y兩點(diǎn)的溶液混合后呈中性,則所需溶液體積MOH更大 組卷:14引用:2難度:0.5 -
8.室溫下,甲、乙兩燒杯均盛有5mL pH=3的某一元酸溶液,向乙燒杯中加水稀釋至pH=4,關(guān)于甲、乙兩燒杯中溶液的描述正確的是( )
A.溶液的體積:10V甲<V乙 B.水電離出的OH-濃度:10c(OH-)甲<c(OH-)乙 C.若分別用等濃度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 D.若分別與5mLpH=11的NaOH溶液反應(yīng),所得溶液的pH:甲≤乙 組卷:455引用:4難度:0.3 -
 9.室溫下,向20.00 mL 0.1000 mol?L-1鹽酸中滴加0.1000 mol?L-1NaOH溶液,溶液的pH隨NaOH溶液體積的變化如圖。已知lg5=0.7.下列說法不正確的是( )
9.室溫下,向20.00 mL 0.1000 mol?L-1鹽酸中滴加0.1000 mol?L-1NaOH溶液,溶液的pH隨NaOH溶液體積的變化如圖。已知lg5=0.7.下列說法不正確的是( )A.NaOH與鹽酸恰好完全反應(yīng)時,pH=7 B.選擇變色范圍在pH突變范圍內(nèi)的指示劑,可減小實(shí)驗(yàn)誤差 C.選擇甲基紅指示反應(yīng)終點(diǎn),誤差比甲基橙的大 D.V(NaOH)=30.00 mL時,pH=12.3 組卷:718引用:22難度:0.7
二、填空題(共3題,共52分)
-
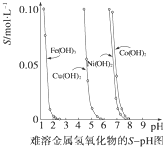 28.金屬氫氧化物在酸中溶解度不同,因此可以利用這一性質(zhì),控制溶液的pH,達(dá)到分離金屬離子的目的。難溶金屬的氫氧化物在不同pH下的溶解度(S/mol?L-1)如圖所示。
28.金屬氫氧化物在酸中溶解度不同,因此可以利用這一性質(zhì),控制溶液的pH,達(dá)到分離金屬離子的目的。難溶金屬的氫氧化物在不同pH下的溶解度(S/mol?L-1)如圖所示。
(1)pH=3時溶液中銅元素的主要存在形式是(寫化學(xué)式)。
(2)若要除去CuCl2溶液中的少量Fe3+,應(yīng)該控制溶液的pH為。
A.<1 B.4左右 C>6
(3)在Ni(NO3)2溶液中含有少量的Co2+雜質(zhì),(填“能”或“不能”)通過調(diào)節(jié)溶液pH的方法來除去,理由是。
(4)已知一些難溶物的溶度積常數(shù)如下表:
某工業(yè)廢水中含有Cu2+、Pb2+、Hg2+,最適宜向此工業(yè)廢水中加入過量的物質(zhì) FeS MnS CuS PbS HgS ZnS Ksp 6.3×10-18 2.5×10-13 1.3×10-36 3.4×10-28 6.4×10-53 1.6×10-24 除去它們(選填序號)。
A.NaOH B.FeS C.Na2S。組卷:82引用:6難度:0.5 -
29.某小組同學(xué)進(jìn)行如圖實(shí)驗(yàn)探究:
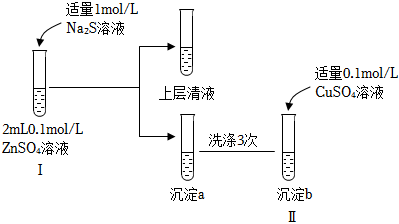
資料:幾種難溶電解質(zhì)的信息
(1)試管Ⅰ中發(fā)生反應(yīng)的離子方程式是難溶電解質(zhì) 顏色 Ksp的數(shù)值(18~25℃) ZnS 白色 1.6×10-24 CuS 黑色 1.3×10-36 FeS 黑色 6.3×10-18 。
(2)試管Ⅱ中觀察到白色沉淀轉(zhuǎn)化為黑色沉淀。請結(jié)合化學(xué)用語,從平衡移動的角度進(jìn)行解釋。
(3)若將沉淀a洗滌3次后,加適量0.1mol/L FeSO4溶液,是否能看到白色沉淀轉(zhuǎn)化為黑色沉淀,請結(jié)合計(jì)算予以說明。組卷:56引用:4難度:0.6


