2022年湖南省普通高中名校聯考高考化學模擬試卷(二)
發布:2024/10/28 5:0:2
一.選擇題:本題共10小題,每小題3分,共30分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.化學科學在“國之重器”的打造中發揮著重要作用。下列有關敘述正確的是( )
A.“墨子號”衛星成功發射實現了光纖量子通信,生產光纖的原料為晶體硅 B.實現海上首飛的“鯤龍”水陸兩棲飛機使用的燃料——航空煤油是一種烴的純凈物 C.長征五號火箭的箭體蒙皮材料2219-鋁合金,可一定程度上減輕火箭的質量 D.“奮斗者”號載人潛水器成功坐底,深度10909m,所用的硬質合金潛孔鉆頭屬于復合材料 組卷:10引用:2難度:0.6 -
2.已知反應:aFeSO4+bNa2O2═cNa2FeO4+2Na2O+dNa2SO4+eO2↑,已知a=2,下列關于該反應的說法正確的是( )
A.3a=b B.氧化性:Na2O2<Na2FeO4 C.每生成1molNa2FeO4,反應有4mol電子轉移 D.每消耗3molNa2O2,產生1molO2 組卷:10引用:3難度:0.7 -
3.下列說法正確的是( )
A.分子式為CH4O和C2H6O的有機物一定互為同系物 B.酚酞的結構為 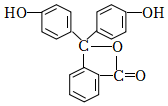 ,其結構中含有羥基(-OH),故酚酞屬于醇類
,其結構中含有羥基(-OH),故酚酞屬于醇類C.治療瘧疾的青蒿素的結構簡式為 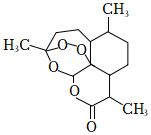 ,分子式是C15H20O5
,分子式是C15H20O5D.分子式為C4H8Br2的有機物,分子中含2個甲基的同分異構體有(不含立體異構)有4種 組卷:72引用:3難度:0.7 -
4.設NA是阿伏加德羅常數的值,下列敘述正確的是( )
A.7g的環丁烷(□)和1-丁烯(CH2═CHCH2CH3)混合氣中含有的極性鍵數為2NA B.鹵素性質相似,標準狀況下,體積分別為1.12L的HCl和HF中所含分子數都約是0.05NA C.1L 0.1mol?L-1HCOONa溶液中,Na+數為0.1NA D.一定量鐵粉溶于1.0L0.4mol?L-1的稀硝酸溶液中,當生成2.24LNO氣體時,溶液中的氮原子數為0.3NA 組卷:15引用:1難度:0.5 -
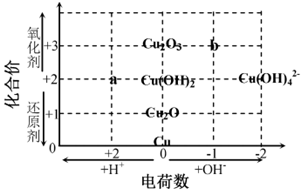 5.如圖是銅及部分含銅粒子的價荷圖。下列推斷不合理的是( )
5.如圖是銅及部分含銅粒子的價荷圖。下列推斷不合理的是( )A.在酸性環境中,Cu變成a需要加氧化劑 B.Cu(OH)42-轉化成Cu(OH)2需要加堿 C.如果將高銅酸根離子(CuO2-)填入坐標,應該填在b的位置 D.在酸性環境中,Cu2O可以歧化成a和Cu 組卷:21引用:2難度:0.6 -
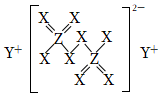 6.短周期主族元素X、Y、Z、W的原子序數依次增大,X和Z位于同一主族,Y的原子半徑是短周期元素中最大的,由X、Y、Z三種元素形成的化合物M結構如圖所示。下列敘述錯誤的是( )
6.短周期主族元素X、Y、Z、W的原子序數依次增大,X和Z位于同一主族,Y的原子半徑是短周期元素中最大的,由X、Y、Z三種元素形成的化合物M結構如圖所示。下列敘述錯誤的是( )A.原子半徑:Z>W B.最簡單氣態氫化物的沸點:X>Z C.WX2、ZX2均為漂白劑,但兩者漂白原理不同 D.由X、Y、Z形成的化合物的水溶液不可能呈堿性 組卷:11引用:2難度:0.5
四、選考題:共15分。請考生從給出的兩道題中任選一題作答。如果多做,則按所做的第一題計分。[選修3:物質結構與性質](15分)
-
18.光刻膠作為集成電路制作過程中的關鍵材料,它的技術水平直接決定了集成電路制作工藝的成敗。感光劑Ⅰ與化合物Ⅱ在堿性條件下反應,生成化合物Ⅲ是某光刻膠工藝的一個環節。
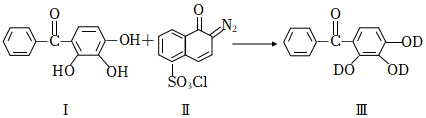
D為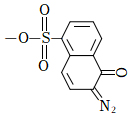
回答下列問題:
(1)基態氮原子的價電子軌道表達式為 。
。
(2)物質Ⅱ中除H元素外,其它元素均位于元素周期表的區。
(3)NH3、CH4、H2S中鍵長最長的是,其分子空間結構為形。
(4)下列說法正確的是(填選項字母)。
A.在Ⅰ中C原子全部采取sp2雜化
B.在Ⅱ中Cl元素的電負性最大
C.在Ⅱ的=N2基團中,存在配位鍵
D.在Ⅲ中硫氧鍵的鍵能均相等
E.在第二周期元素中,第一電離能(I1)比氮大的元素有3種
(5)光刻膠原理是利用反應前后,不同物質在刻蝕液中溶解性的差異,形成不同的圖形。化合物Ⅰ與化合物Ⅲ相比,水溶性較好的是,原因是。
(6)C603-能與K+形成超分子加合物,如圖所示,該晶胞中K+的數目為,已知晶胞參數為acm,阿伏加德羅常數的值為NA,則該晶胞的密度為g/cm3 (列出計算式即可)。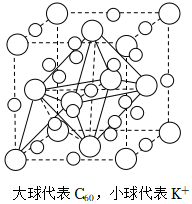 組卷:15引用:2難度:0.6
組卷:15引用:2難度:0.6
五、[選修5:有機化學基礎](共1小題,滿分0分)
-
19.環丙胺(
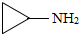 )是合成新型抗菌素、除草劑等產品的中間體。以γ-丁內酯(
)是合成新型抗菌素、除草劑等產品的中間體。以γ-丁內酯(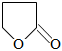 )為原料合成環丙胺的傳統“五步合成法”工藝如圖。
)為原料合成環丙胺的傳統“五步合成法”工藝如圖。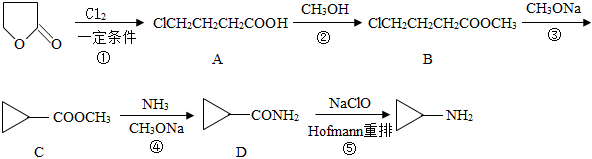
回答下列問題:
(1)γ-丁內酯的分子式為,本工藝中兩次用到的CH3ONa的名稱為。
(2)B中官能團的名稱為。
(3)B→C反應過程中還生成了醇和無機鹽,該反應的化學方程式為。
(4)與A分子式相同,且分子中含有酯基的同分異構體有種。
(5)環氧丁烯(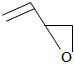 )來源豐富且經濟,利用環氧丁烯合成環丙胺是目前一些國家正在研發的項目,其前兩步反應過程如下。
)來源豐富且經濟,利用環氧丁烯合成環丙胺是目前一些國家正在研發的項目,其前兩步反應過程如下。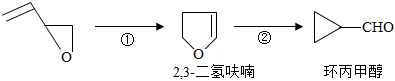
下列關于環氧丁烯和2,3-二氫呋喃的說法不正確的是(填標號)。
a.二者分子式相同互為同分異構體
b.二者均能發生取代、氧化、加成反應
c.可以用酸性KMnO4溶液鑒別二者
(6)環丙甲醛再經過四步反應即可得到環丙胺,寫出合成路線。組卷:12引用:2難度:0.5


