2022年山東省淄博市高考化學三模試卷
發布:2025/1/7 13:0:3
一、選擇題(本題包括10小題,每小題只有一個選項符合題意,每小題2分,共20分)
-
1.海洋是豐富的資源寶庫,山東省科技賦能深耕海洋經濟,位于全國之首。下列說法錯誤的是( )
A.從海水中提取的氘用于可控核聚變,氘與氕互為同位素 B.從海水中提取液溴、金屬鉀和鎂的生產過程中,都涉及氧化還原反應 C.海洋藻類滸苔可用于提煉“生物原油”,“生物原油”的主要成分是碳氫化合物 D.全降解血管支架的材料是從蝦蟹殼中提取的甲殼質(一種多糖物質),甲殼質屬于高分子化合物 組卷:29引用:1難度:0.7 -
2.化學與生活密切相關。下列應用不涉及氧化還原反應的是( )
A.甲醛能使蛋白質失去生理活性 B.密封的食品包裝中常放置有一小包鐵粉 C.市售的食用油中普遍加入叔丁基對苯二酚 D.食用維生素C含量較高的食品有利于鐵元素的吸收 組卷:30引用:1難度:0.7 -
 3.在“價—類”二維圖中融入“杠桿模型”,可直觀辨析部分物質轉化及其定量關系。如圖所示,圖中的字母分別代表硫及其常見化合物,相關推斷不合理的是( )
3.在“價—類”二維圖中融入“杠桿模型”,可直觀辨析部分物質轉化及其定量關系。如圖所示,圖中的字母分別代表硫及其常見化合物,相關推斷不合理的是( )A.b、d、f既具有氧化性又具有還原性 B.硫酸型酸雨的形成過程涉及b到c的轉化 C.d與c在一定條件下反應可生成b或a D.d在加熱條件下與強堿溶液反應生成e和f,且n(e):n(f)=2:1 組卷:47引用:3難度:0.8 -
4.通過電解KI和丙酮的水溶液來制備碘仿。已知:
制得的粗碘仿中含少量石墨粉、丙酮,則分離提純碘仿的操作中,下列儀器一定不會用到的( )物質 熔點/℃ 沸點/℃ 溶解性 丙酮(CH3COCH3) -95 56 與水、乙醇互溶 碘仿(CH3) 120 218 不溶于水,溶于熱乙醇 A. 
B. 
C. 
D.  組卷:21引用:1難度:0.5
組卷:21引用:1難度:0.5 -
 5.已知X、Y、Z、W是同一短周期主族元素。單質W3具有強氧化性,可用于殺菌消毒。四種元素與鋰離子組成的鹽是一種新型的鋰離子電池的電解質,結構如圖所示(“→”表示配位鍵)。下列說法正確的是( )
5.已知X、Y、Z、W是同一短周期主族元素。單質W3具有強氧化性,可用于殺菌消毒。四種元素與鋰離子組成的鹽是一種新型的鋰離子電池的電解質,結構如圖所示(“→”表示配位鍵)。下列說法正確的是( )A.原子半徑:X>Y>Z>W B.Y的最高價氧化物的水化物為強酸 C.單質氧化性:W2>X2 D.陰離子中四種元素的原子均滿足8電子穩定結構 組卷:23引用:1難度:0.6 -
 6.N-異丙基丙烯酰胺可形成一種高分子膜,在一定溫度范圍內有溫敏特性,結構如圖所示。已知酰胺基具有親水性、異丙基具有疏水性。下列說法錯誤的是( )
6.N-異丙基丙烯酰胺可形成一種高分子膜,在一定溫度范圍內有溫敏特性,結構如圖所示。已知酰胺基具有親水性、異丙基具有疏水性。下列說法錯誤的是( )A.可通過加聚反應合成此高分子膜 B.A過程中,高分子膜有O-H鍵的形成 C.B過程為降溫過程 D.高分子膜在A過程發生體積收縮,原因是酰胺基之間形成了氫鍵 組卷:33引用:1難度:0.8
三、本題包括5小題,共60分。答案必須寫在答題卡內相應的位置,不能寫在試卷上。
-
19.以固體廢鋅催化劑(主要成分為ZnO及少量Fe2O3、CuO、MnO、SiO2)為原料制備鋅的工藝流程如圖:
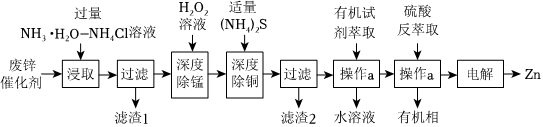
已知:①“浸取”時。ZnO、CuO轉化為[Zn(NH3)4]2+、[Cu(NH3)4]2+進入溶液;
②25℃時,Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24;
③深度除雜標準:溶液中n(雜質離子)n{[Zn(NH3)4]2+}≤2.0×10-6
(1)為提高鋅浸出率,必須采取的措施是;“浸取”溫度為30℃時,鋅浸出率可達90.6%,繼續升溫浸出率反而下降,其原因為。
(2)“操作a”的名稱為。
(3)“深度除錳”是在堿性條件下將殘留的Mn2+轉化為MnO2,離子方程式為。
(4)“深度除銅”時,鋅的最終回收率、除銅效果[除銅效果以反應后溶液中銅鋅比表示]與“(NH4)2S加入量”[以n(Cu2+)n{[Zn(NH3)4]2+}×100%表示]的關系曲線如圖所示。n(實際用量)n(理論用量)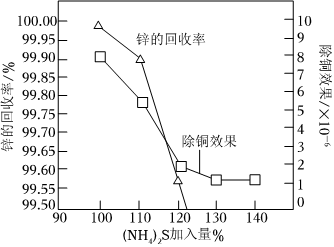
①當(NH4)2S加入量≥100%時,鋅的最終回收率下降的原因是(用離子方程式表示),該反應的平衡常數為,(已知[Zn(NH3)4]2+的K穩=)c[Zn(NH3)4]2+c(Zn2+)?c4(NH3)=2.9×109
②“深度除銅”時(NH4)2S加入量最好應選。
a.100%
b.110%
c.120%
d.130%
(5)測定反萃取水相中Zn2+的濃度:量取20.00mL反萃取水相于錐形瓶中,用0.0100mol/L EDTA(乙二胺四乙酸鈉Na2H2Y)標準溶液滴定至終點(Zn2++H2Y2-═ZnY2-+2H+)。重復實驗三次,平均消耗標準溶液22.30mL。則反萃取水相中Zn2+的濃度為(保留兩位小數)。組卷:74引用:2難度:0.3 -
20.CH4與CO2重整是CO2利用的研究熱點之一。該重整反應體系有以下反應:
Ⅰ.CO2(g)+CH4(g)?2CO(g)+2H2(g)ΔH1
Ⅱ.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2=+41.2kJ/mol
Ⅲ.CH4(g)?C(g)+2H2(g)ΔH3(只在高溫下自發進行)
(1)已知25℃、101kPa時CH4(g)、CO(g)和H2(g)的燃燒熱分別為890.0kJ?mol-1、283.0kJ?mol-1和285.8kJ?mol-1,則ΔH1=。ΔH30(填“>”或“<”)。
(2)在一定壓強和催化劑的條件下,將等物質的量的CO2和CH4通入重整反應器中,平衡時,CO2、CH4的物質的量分數及轉化率隨溫度變化的關系如圖1所示。
①平衡時CO2的物質的量分數隨溫度變化的曲線是(填標號)。
②溫度高于1300K后,曲線d超過曲線c的可能原因為。
(3)在pMPa時,將CO2和CH4按物質的量之比為1:1充入密閉容器中,分別在無催化劑和ZrO2催化下反應相同時間,所得CO2的轉化率、催化劑活性與溫度的關系如圖2所示。
①a點CO2轉化率相等的原因是。
②在900℃、ZrO2催化條件下,將CO2、CH4、H2O按物質的量之比為1:1:n充入密閉容器,CO2的平衡轉化率大于50%,原因是。
(4)設Kpr為相對壓力平衡常數,用相對分壓代替濃度即可得相對壓力平衡常數的表達式[氣體的相對分壓等于其分壓(單位為kPa)除以標準壓強p0(p0=100kPa)]。某溫度下反應Ⅲ的Kpr=1,向恒容密閉容器中按投料比n(CO2):n(CH4)=1:1充入原料氣,初始總壓為150kPa,發生反應Ⅰ、Ⅱ、Ⅲ,體系達到平衡時H2的分壓為bkPa,則CH4的平衡轉化率為。組卷:27引用:1難度:0.6


