2021-2022學年安徽省六安一中高三(上)第四次月考化學試卷
發布:2024/12/31 9:0:3
一、單項選擇題(本題共16小題,每小題3分,共48分)
-
1.下列現象或事實及其解釋均正確的是( )
選項 現象與事實 解釋 A FeCl3溶液可用于刻蝕制作銅質印刷線路板 FeCl3能從含Cu2+的溶液中置換出銅 B 漂白粉在空氣中久置變質 漂白粉中的CaCl2與空氣中的CO2反應生成CaCO3 C 施肥時,草木灰(有效成分為K2CO3)不能與NH4Cl混合使用 K2CO3與NH4Cl反應生成氨氣會降低肥效 D Al2(SO4)3和Na2CO3用作泡沫滅火器原料 Al2(SO4)3和Na2CO3可發生雙水解反應生成CO2 A.A B.B C.C D.D 組卷:5引用:1難度:0.7 -
2.NA表示阿伏加德羅常數的值。下列說法中,不正確的是( )
A.在反應KClO3+6HCl(濃)═KCl+3Cl2↑+3H2O中,每生成3molCl2轉移的電子數為5NA B.電解精煉銅時,當電路中轉移NA個電子,陽極溶解32g銅 C.一定條件下,2.3gNa與O2完全反應生成3.6g產物時失去的電子數0.1NA D.向僅含0.2molFeI2的溶液中持續通入氯氣,當有0.1molFe2+被氧化時,轉移電子的數目為0.5NA 組卷:2引用:1難度:0.7 -
 3.下列各組物質中,不滿足如圖物質間轉化關系(物質間的反應均為一步轉化)的選項是( )
3.下列各組物質中,不滿足如圖物質間轉化關系(物質間的反應均為一步轉化)的選項是( )選項 X Y Z A Al NaAlO2 Al(OH)3 B Fe FeCl3 FeCl2 C NaOH NaHCO3 Na2CO3 D SiO2 Na2SiO3 H2SiO3 A.A B.B C.C D.D 組卷:35引用:4難度:0.7 -
4.用下列實驗裝置進行相應的實驗,操作錯誤或不能達到實驗目的的是( )
A. 
如圖用于實驗室制氨氣并收集干燥的氨氣B. 
如圖用于除去CO2中含有的少量HClC. 
如圖用NaOH標準溶液滴定錐形瓶中的鹽酸D. 
用如圖裝置制備Fe(OH)2并能較長時間觀察其顏色組卷:1引用:1難度:0.5 -
5.下列離子方程式書寫正確的是( )
A.飽和Na2CO3溶液中通入過量CO2:CO32-+CO2+H2O═2HCO3- B.過量的鐵和稀硝酸反應:Fe+NO3-+4H+═Fe3++NO↑+2H2O C.FeI2溶液中通入少量Cl2:Cl2+2Fe2+═2Fe3++2Cl- D.Ca(HCO3)2溶液中滴入少量Ca(OH)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O 組卷:15引用:1難度:0.7 -
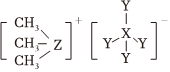 6.科學家合成出了一種用于分離鑭系金屬的化合物A,其結構如圖所示。短周期元素X、Y、Z原子序數依次增大,其中Z位于第三周期。Z與Y2可以形成分子ZY6,該分子常用作高壓電氣設備的絕緣介質。下列關于X、Y、Z的敘述正確的是( )
6.科學家合成出了一種用于分離鑭系金屬的化合物A,其結構如圖所示。短周期元素X、Y、Z原子序數依次增大,其中Z位于第三周期。Z與Y2可以形成分子ZY6,該分子常用作高壓電氣設備的絕緣介質。下列關于X、Y、Z的敘述正確的是( )A.化合物A中,X、Y、Z最外層都達到8電子穩定結構 B.離子半徑:Y>Z C.最簡單氫化物的沸點:Z>Y D.最高價氧化物對應水化物的酸性:Z<X 組卷:38引用:4難度:0.5 -
7.鐵的配合物離子(用[L-Fe-H]+表示)催化某反應的一種反應機理和相對能量的變化情況如圖所示:

下列說法錯誤的是( )A.該過程的總反應為HCOOH CO2↑+H2↑催化劑B.H+濃度過大或者過小,均導致反應速率降低 C.該催化循環中Fe元素的化合價沒有發生變化 D.該過程的總反應速率由反應過程中的Ⅳ→Ⅰ步驟決定 組卷:50引用:4難度:0.7
二、非選擇題(本題共6小題,共52分)
-
 21.升高溫度絕大多數的化學反應速率增大,但是2NO(g)+O2(g)?2NO2(g)ΔH<0的速率卻隨溫度的升高而減小。某化學小組為研究特殊現象的實質原因,查閱資料知:
21.升高溫度絕大多數的化學反應速率增大,但是2NO(g)+O2(g)?2NO2(g)ΔH<0的速率卻隨溫度的升高而減小。某化學小組為研究特殊現象的實質原因,查閱資料知:
2NO(g)+O2(g)?2NO2(g)的反應歷程分兩步:
①2NO(g)?N2O2(g)(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)ΔH1<0
②N2O2(g)+O2(g)?2NO2(g)(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
(1)一定溫度下,反應2NO(g)+O2(g)?2NO2(g)達到平衡狀態,請寫出用k1正、k1逆、k2正、k2逆表示的平衡常數表達式K=。根據速率方程分析,升高溫度該反應速率減小的原因是(填字母)。
a.k2正增大,c(N2O2)增大
b.k2正減小,c(N2O2)減小
c.k2正增大,c(N2O2)減小
d.k2正減小,c(N2O2)增大
(2)由實驗數據得到v2正~c(O2)的關系可用如圖表示。當x點升高到某一溫度時,反應重新達到平衡,則變為相應的點可能為(填字母)。組卷:1引用:1難度:0.6 -
22.乙醇部分氧化法制氫是一種較有發展前景的制氫方法。過程中主要包含以下兩個反應:
反應Ⅰ:C2H5OH(g)+O2(g)122CO(g)+3H2(g) ΔH1K1
反應Ⅱ:C2H5OH(g)+O2(g)322CO2(g)+3H2(g) ΔH2K2
已知:反應Ⅲ:2CO(g)+O2(g)?2CO2(g)ΔH3<0
回答下列問題:
(1)反應Ⅰ、Ⅱ的平衡常數K與溫度變化關系如圖所示。則ΔH10(填“>”、“<”或“=”);ΔH2ΔH31(填“>”、“<”或“=”).
(2)向某1L的反應容器中加入1mol的乙醇氣體和xmol氧氣,在溫度等于T1時,體系達到平衡狀態,此時n(O2)=1mol,乙醇的轉化率為40%;已知反應Ⅲ的化學平衡常數K3=9.0,則x=mol;反應Ⅰ的平衡常數K1=。(保留四位有效數字)
(3)在恒溫恒容的密閉容器中,不能作為該反應體系達到平衡狀態的標志是(填字母)
A.乙醇的物質的量不變
B.氣體密度不再變化
C.斷裂1molC-C鍵的同時生成3molH-H
D.容器的壓強不再發生變化組卷:1引用:1難度:0.7


