2021-2022學年黑龍江省大慶市林甸一中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括14小題,每小題3分,共42分。每小題只有一個選項符合題意)
-
1.未來新能源的特點是資源豐富,在使用時對環境無污染或污染很小,且可以再生.下列屬于未來新能源標準的是( )
①天然氣 ②太陽能 ③風能 ④石油 ⑤煤 ⑥生物質能 ⑦核能 ⑧氫能.A.①②③④ B.②③⑥⑧ C.①②⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ 組卷:211引用:11難度:0.9 -
2.氨水有下列平衡:NH3?H2O?
+OH- 當其它條件不變時,改變下列條件,平衡向左移動,且c(NH+4)增大的是( )NH+4A.加NaOH B.加鹽酸 C.加NH4Cl D.加熱 組卷:131引用:10難度:0.9 -
3.銅鋅原電池(如圖)工作時,下列敘述錯誤的是( )

A.正極反應為:Cu2++2e-═Cu B.電池反應為:Zn+Cu2+═Zn2++Cu C.在外電路中,電子從負極流向正極 D.鹽橋中的K+移向ZnSO4溶液 組卷:21引用:10難度:0.9 -
4.在由水電離產生的c(H+)=1×10-14mol/L的溶液中,一定可以大量共存的離子組是( )
A.K+、Ba2+、Cl-、 NO-3B.Na+、Ca2+、I-、 NO-3C. 、Al3+、Br-、NH+4SO2-4D.K+、Na+、 、HCO-3SO2-4組卷:27引用:13難度:0.9 -
5.已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(AgBr)=7.7×10-13,則下列難溶鹽的飽和溶液中,Ag+濃度大小順序正確的是( )
A.AgCl>AgI>AgBr B.AgCl>AgBr>AgI C.AgBr>AgCl>AgI D.AgBr>AgI>AgCl 組卷:123引用:21難度:0.7 -
6.已知:△G=△H-T△S,△G為自由能變化,△H為焓變,T為熱力學溫度,△S熵變.當△G<0時反應能自發進行,△G>0時反應不能自發進行.據此下列敘述中正確的是( )
A.熵變大于零的反應肯定能自發進行 B.焓變小于零的反應肯定能自發進行 C.焓變大于零的反應肯定不能自發進行 D.焓變小于零且熵變大于零的反應一定能自發進行 組卷:38引用:5難度:0.9
二、非選擇題(本題包括6小題,共58分)
-
19.海水中蘊藏著豐富的資源,海水綜合利用的流程圖如下:

(一)某化學研究小組用圖裝置模擬步驟Ⅰ電解食鹽水(用鐵和石墨做電極)。
(1)a電極材料是(填鐵、石墨),其電極反應式為。
(2)當陰極產生11.2mL氣體時(標準狀況),該溶液的pH為(忽略反應前后溶液體積的變化)。
(二)鹵水中蘊含著豐富的鎂資源,就MgCl2粗產品的提純、鎂的冶煉過程回答下列問題:
已知MgCl2粗產品的溶液中含有Fe2+、Fe3+和Al3+.如表是生成氫氧化物沉淀的pH:
(3)把MgCl2粗產品的溶液中的Fe2+轉化為Fe3+,可選用的物質是物質 Fe(OH)3 Fe(OH)2 Al(OH)3 Mg(OH)2 開始沉淀pH 2.7 8.1 3.8 9.5 完全沉淀pH 3.7 9.6 4.8 11.0 (填序號,下同),加入調節溶液的pH,充分反應后過濾,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步驟Ⅲ由MgCl2?H2O獲得MgCl2的操作是:
(三)制取工業溴:
(5)步驟Ⅳ中已獲得Br2,步驟Ⅴ中又將Br2還原為Br-,其目的是。
(6)寫出步驟Ⅴ用SO2水溶液吸收Br2的離子方程式:。組卷:6引用:3難度:0.7 -
20.請運用化學反應原理的相關知識研究碳及其化合物的性質。
(1)工業上可利用CO或CO2來制備清潔液體燃料甲醇。已知:800℃時,化學反應①、反應②對應的平衡常數分別為2.5、1.0。
反應①:2H2(g)+CO(g)?CH3OH(g)ΔH=-90.8kJ?mol-1
反應②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ?mol-1
寫出用CO2與H2反應制備甲醇的熱化學方程式:,800℃時該反應的化學平衡常數K的數值為。
(2)現將不同量的CO2(g)和H2(g)分別通入到容積為2L的恒容密閉容器中發生反應:H2(g)+CO2(g)?H2O(g)+CO(g) ΔH=+41.2kJ?mol-1,得到如下二組數據:
實驗2中,若平衡時,CO2(g)的轉化率小于H2(g),則a、b必須滿足的關系是實驗組 溫度/℃ 起始量/mol 平衡量/mol 達到平衡所需時間/min CO2(g) H2(g) H2(g) CO2(g) 1 900 4 2 1.6 2.4 2 2 900 a b c d t 。若在900℃時,另做一組實驗,在此容器中加入10molCO2(g)、5molH2、2molCO、5molH2O(g),則此時v正v逆(填“<”、“>”或“=”)。
(3)工業上可通過甲醇羰基化法制取甲酸甲酯,其反應的熱化學方程式為CH3OH(g)+CO(g)?HCOOCH3(g) ΔH=-29.1kJ?mol-1,科研人員對該反應進行了研究,部分研究結果如圖: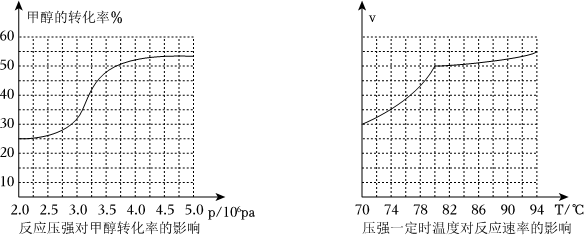
①從反應壓強對甲醇轉化率的影響“效率”看,工業制取甲酸甲酯應選擇的壓強是(填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②實際工業生產中采用的溫度是80℃,其理由是。
(4)科研人員設計了一種新型甲醇燃料電池,其電解質是摻雜了Y2O3的ZrO2晶體,它在高溫下能傳導O2-,該電池工作時的負極反應式為。組卷:7引用:1難度:0.5


