2020-2021學(xué)年四川省達州市大竹中學(xué)高二(下)月考化學(xué)試卷(3月份)
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題共25個小題,每題2分,共50分)
-
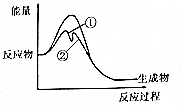 1.合金ThNi5可催化反應(yīng)C(g)+3H2(g)?CH4(g)+H2O(g),在一定溫度下,反應(yīng)過程中有無催化劑的能量變化如圖。下列敘述正確的是( )
1.合金ThNi5可催化反應(yīng)C(g)+3H2(g)?CH4(g)+H2O(g),在一定溫度下,反應(yīng)過程中有無催化劑的能量變化如圖。下列敘述正確的是( )A.使用催化劑時反應(yīng)的速率主要決定于第②步 B.縮小體積可加快該反應(yīng)速率,是因為增大了活化分子百分數(shù) C.使用催化劑降低反應(yīng)的焓變,降低溫度有利于產(chǎn)物的生成 D.升高溫度,平衡常數(shù)減小 組卷:28引用:2難度:0.5 -
2.下列說法正確的是( )
A.將NaOH溶液分多次緩慢注入鹽酸中,還是一次性快速注入鹽酸中,都不影響中和熱測定 B.已知反應(yīng)的中和熱為△H=-57.3 kJ?mol-1,則稀H2SO4和稀Ca(OH)2溶液反應(yīng)的中和熱△H=-2×57.3 kJ?mol-1 C.燃燒熱是指在101 kPa時可燃物完全燃燒時所放出的熱量,故S(s)+ O2(g)═SO3(g)△H=-315 kJ?mol-1即為硫的燃燒熱32D.已知冰的熔化熱為6.0 kJ?mol-1,冰中氫鍵鍵能為20.0 kJ?mol-1,假設(shè)1 mol冰中有2 mol氫鍵,且熔化熱完全用于破壞冰中的氫鍵,則最多只能破壞1 mol冰中15%的氫鍵 組卷:64引用:5難度:0.5 -
3.下列事實不能用勒夏特列原理解釋的是( )
A.工業(yè)上生產(chǎn)硫酸的過程中使用過量的空氣以提高SO2的利用率 B.打開可樂瓶蓋時,可樂飲料中常常會生產(chǎn)大量氣體 C.工業(yè)合成氨氣時加入催化劑提高反應(yīng)速率 D.冷卻一定體積的NO2后,氣體顏色變淡 組卷:2引用:1難度:0.7 -
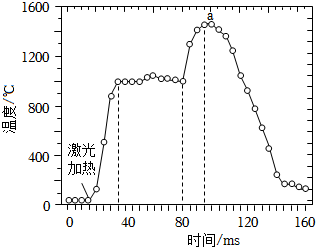 4.AlH3是一種儲氫材料,可作為固體火箭推進劑中的金屬燃燒劑。通過激光加熱引發(fā)AlH3的燃燒反應(yīng),燃燒過程中其表面溫度隨時間的變化關(guān)系如圖所示。燃燒不同階段發(fā)生的主要變化如下:2AlH3(s)═2Al(s)+3H2(g)△H1;H2(g)+O2(g)═H2O(g)△H2;Al(s)═Al(g)△H3;Al(g)+12O2(g)═34Al2O3(g)△H4。下列說法正確的是( )12
4.AlH3是一種儲氫材料,可作為固體火箭推進劑中的金屬燃燒劑。通過激光加熱引發(fā)AlH3的燃燒反應(yīng),燃燒過程中其表面溫度隨時間的變化關(guān)系如圖所示。燃燒不同階段發(fā)生的主要變化如下:2AlH3(s)═2Al(s)+3H2(g)△H1;H2(g)+O2(g)═H2O(g)△H2;Al(s)═Al(g)△H3;Al(g)+12O2(g)═34Al2O3(g)△H4。下列說法正確的是( )12A.AlH3燃燒需要激光加熱引發(fā),所以AlH3燃燒是吸熱反應(yīng) B.H2(g)的燃燒熱△H<△H2 C.加入某種催化劑,反應(yīng)的△H會發(fā)生變化 D.在反應(yīng)過程中,a點物質(zhì)具有的總能量最大 組卷:24引用:3難度:0.5 -
5.一定量的鹽酸跟過量的鐵粉反應(yīng)時,為了減慢反應(yīng)速率,而不影響生成H2的總量,可向其中加入適量的( )
A.Na2CO3晶體 B.NaOH晶體 C.水 D.CuSO4晶體 組卷:8引用:2難度:0.7 -
6.反應(yīng)C(s)+H2O(g)?CO(g)+H2(g)在一定容積的密閉容器中進行,則下列說法或結(jié)論中,能夠成立的是( )
A.其他條件不變,僅將容器的體積縮小一半,反應(yīng)速率加快 B.保持體積不變,充入少量He氣體使體系壓強增大,反應(yīng)速率一定增大 C.反應(yīng)達平衡狀態(tài)時:v(C)正=v(H2O)逆 D.其他條件不變,適當(dāng)增加C(s)的質(zhì)量會使反應(yīng)速率增大 組卷:9引用:3難度:0.7 -
7.下列說法正確的是( )
A.H2(g)+I2(g)?2HI(g),其他條件不變,縮小反應(yīng)容器體積,正逆反應(yīng)速率不變 B.C(s)+H2O(g)?H2(g)+CO(g),碳的質(zhì)量不再改變說明反應(yīng)已達平衡 C.若壓強不再隨時間變化能說明反應(yīng)2A(?)+B(g)?2C(?)已達平衡,則A、C不能同時是氣體 D.1molN2和3molH2反應(yīng)達到平衡時H2轉(zhuǎn)化率為10%,放出熱量Q1;在相同溫度和壓強下,當(dāng)2molNH3分解為N2和H2的轉(zhuǎn)化率為10%時,吸收熱量至Q2,Q2不等于Q1 組卷:1109引用:35難度:0.6 -
8.我國科研人員提出了由CO2和CH4轉(zhuǎn)化為CH3COOH的催化反應(yīng)歷程,該催化反應(yīng)歷程示意圖如圖。下列說法錯誤的是( )
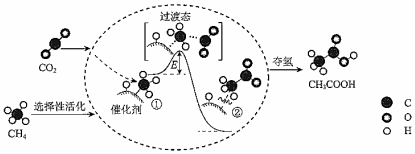
A.①→②放出能量并形成了C-C鍵 B.CH4→CH3COOH過程中,有C-H鍵發(fā)生斷裂 C.該催化劑可有效提高反應(yīng)物的平衡轉(zhuǎn)化率 D.生成CH3COOH總反應(yīng)的原子用率為100% 組卷:68引用:5難度:0.5 -
9.常壓下羰基化法精煉鎳的原理為:Ni(s)+4CO(g)?Ni(CO)4(g)。230℃時,該反應(yīng)的平衡常數(shù)K=2×10-5.已知:Ni(CO)4的沸點為42.2℃,固體雜質(zhì)不參與反應(yīng)。
第一階段:將粗鎳與CO反應(yīng)轉(zhuǎn)化成氣態(tài)Ni(CO)4;
第二階段:將第一階段反應(yīng)后的氣體分離出來,加熱至230℃制得高純鎳。
下列判斷正確的是( )A.降低c(CO),平衡逆向移動,反應(yīng)的平衡常數(shù)減小 B.第一階段,在30℃和50℃兩者之間選擇反應(yīng)溫度,選50℃ C.第二階段,Ni(CO)4分解率較低 D.該反應(yīng)達到平衡時,v生成[Ni(CO)4]=4v生成(CO) 組卷:63引用:3難度:0.5
二、非選擇題(本題共4個小題,共50分)
-
28.合成氣的生產(chǎn)和應(yīng)用在化學(xué)工業(yè)中有極為重要的地位。回答下列問題:
(1)利用合成氣(主要成分CO、CO2和H2)在催化劑作用下合成甲醇,可能發(fā)生的反應(yīng)有:
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-63kJ?mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2
③CH3OH(g)?CO(g)+2H2(g)△H3
已知部分化學(xué)鍵鍵能數(shù)據(jù)如表:
則△H3=化學(xué)鍵 H-H C=O C 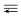 O
OO-H 鍵能(kJ?mol-1) 436 803 1076 465 kJ?mol-1。
(2)工業(yè)上可用CH4-H2O催化重整法制備合成氣,其原理為:
反應(yīng)ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)
反應(yīng)ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)
將1mol CH4(g)和1mol H2O(g)充入溫度恒為298K、壓強恒為100kPa的密閉容器中,發(fā)生反應(yīng)ⅰ,不考慮反應(yīng)ⅱ的發(fā)生。反應(yīng)ⅰ中,正反應(yīng)速率v正=k正×p(CH4)×p(H2O),p為分壓(分壓=總壓×物質(zhì)的量分數(shù))。若該條件下k正=4.5×10-4kPa-1?s-1,當(dāng)CH4分解率為20%時,v正=kPa?s-1。
(3)CO2和CH4在一定條件下反應(yīng)也可制得合成氣。在1.0L密閉容器中充入1.0mol CH4和1.0mol CO2,在一定條件下發(fā)生反應(yīng)CH4(g)+CO2(g)?2CO(g)+2H2,測得CH4的平衡轉(zhuǎn)化率與溫度及壓強的關(guān)系如圖1所示。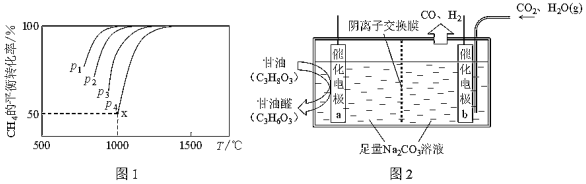
①比較壓強大小:p1p3。(填“>”、“<”或“=”)
②若要提高CH4的平衡轉(zhuǎn)化率,可采取的措施有,。(任寫兩條)
③若p4=2.0MPa,則x點的平衡常數(shù)Kp=。(用平衡分壓代替平衡濃度計算)
(4)科學(xué)家設(shè)計了一種電解裝置,能將甘油(C3H8O3)和二氧化碳轉(zhuǎn)化為甘油醛(C3H6O3)和合成氣,裝置如圖2所示。
①催化電極b應(yīng)與電源(填“正”或“負”)極相連。
②電解一段時間后,催化電極a附近的pH值將(填“增大”、“減小”或“不變”),用電極反應(yīng)方程式解釋原因:。
③當(dāng)外電路轉(zhuǎn)移2mol e-時,生成的合成氣在標況下的體積為。組卷:57引用:2難度:0.3 -
29.銅及其化合物在科學(xué)研究和工業(yè)生產(chǎn)中具有許多用途。回答下列問題:
(1)Cu2O中陽離子的基態(tài)核外電子排布式為;Cu和Ni在元素周期表中的位置相鄰,Ni在元素周期表中的位置是。
(2)將過量的氨水加到硫酸銅溶液中,溶液最終變成深藍色,繼續(xù)加入乙醇,析出深藍色的晶體[Cu(NH3)4]SO4?H2O。
①乙醇分子中C原子的雜化軌道類型為;NH3能與H+以配位鍵形成NH4+的立體構(gòu)型是。
②[Cu(NH3)4]SO4?H2O中存在的化學(xué)鍵除了極性共價鍵外,還有。
(3)CuSO4溶液中加入過量KCN溶液能生成配離子[Cu(CN)4]2-,1molCN-中含有的π鍵數(shù)目為,
與CN-互為等電子體的離子有(寫出一種即可)。
(4)Cu與F形成的化合物的晶胞結(jié)構(gòu)如圖1所示,若晶體密度為ag?cm-3,則Cu與F最近距離為pm(用NA表示阿伏加德羅常數(shù)的值,列出計算式,不用化簡)。
(5)某晶體晶胞結(jié)構(gòu)如圖2所示,其中Cu均勻地分散在立方體內(nèi)部,a、b的坐標參數(shù)依次為(0,0,0)、(,12,12),則d點Cu原子的坐標參數(shù)為12。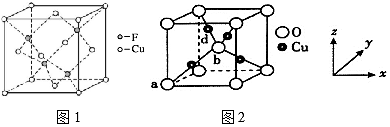 組卷:8引用:1難度:0.2
組卷:8引用:1難度:0.2


