2021-2022學年江蘇省泰州中學高三(上)質檢化學試卷(12月份)
發布:2024/9/14 16:0:8
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.化學與生產、生活和社會發展密切相關,下列敘述正確的是( )
A.“雷雨發莊稼”說明有銨鹽生成 B.二氧化氯泡騰片和75%酒精均可殺滅COVID-19,二者消毒時均表現為強氧化性 C.臺積電斷供華為5G手機麒麟9000芯片(HUAWEI Kirin),此芯片主要成分是二氧化硅 D.“忽聞海上有仙山,山在虛無縹緲間”的海市蜃樓是一種自然現象,與膠體知識有關 組卷:22引用:4難度:0.7 -
2.乙醛發生銀鏡反應的化學方程式為CH3CHO+2Ag(NH3)2OH
2Ag↓+CH3COONH4+3NH3↑+H2O。下列說法正確的是( )△A.CH3CHO分子中σ鍵與π鍵的比例為6:1 B.配離子[Ag(NH3)2]+中提供孤電子對形成配位鍵的是Ag+ C.NH3的電子式為 
D.CH3COONH4中碳原子的軌道雜化方式均為sp3雜化 組卷:64引用:3難度:0.6 -
3.閱讀下列資料,完成3~5題:氮、磷、砷元素廣泛應用于生產生活中,NH3、N2H4(肼)、NO、NO2、HNO3等是氮重要的無機化合物,白磷(P4)易自燃,易溶于CS2;Ca(H2PO4)2是磷肥的有效成分;砷化鎵是重要的半導體材料.
下列關于氮、磷、砷三種元素及其單質、化合物的說法正確的是( )A.磷肥與草木灰混合后施肥效果一定會更佳 B.肼的沸點為113.5℃,說明肼分子間不存在氫鍵 C.白磷分子(P4)是非極性分子,白磷不能保存在水中 D.氮、磷、砷三種元素的第一電離能大小關系:N>P>As 組卷:3引用:0難度:0.50 -
4.閱讀下列資料,完成3~5題:氮、磷、砷元素廣泛應用于生產生活中,NH3、N2H4(肼)、NO、NO2、HNO3等是氮重要的無機化合物,白磷(P4)易自燃,易溶于CS2;Ca(H2PO4)2是磷肥的有效成分;砷化鎵是重要的半導體材料.
下列氮及其化合物的性質與用途不具有對應關系的是( )A.N2不溶于水,部分地區儲藏蔬菜和水果常充氮氣來防氧化 B.液氨易氣化,可用作制冷劑 C.KNO3具有氧化性,可用于制黑火藥 D.硫酸銨溶液水解顯酸性,可用作除銹劑 組卷:1引用:0難度:0.70 -
5.閱讀下列資料,完成4~5題。
由于化石燃料的長期大量消耗,傳統能源逐漸枯竭,而人類對能源的需求量越來越高,氫能源和化學電源的開發與利用成為全球發展的重要問題。
水合肼(N2H4?H2O)是重要的氫能源穩定劑,其制備的反應原理為NaClO+2NH3=N2H4?H2O+NaCl。下列裝置和操作不能達到實驗目的的是( )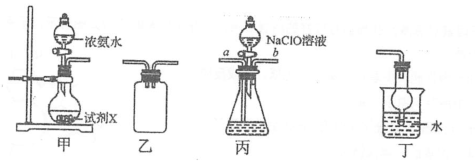
A.在裝置甲的圓底燒瓶中加入堿石灰制取NH3 B.用裝置乙作為反應過程的安全瓶 C.制備水合肼時從裝置丙的b口通入NH3 D.用裝置丁吸收反應中過量的NH3 組卷:9引用:0難度:0.60
二、非選擇題:共4題,共58分。
-
17.ClO2是一種強氧化性氣體,在消毒和果蔬保鮮等方面應用廣泛。ClO2易溶于水,易與堿液反應。ClO2濃度大時易分解爆炸,在生產和使用時必須用稀有氣體或空氣等進行稀釋,實驗室常用下列方法制備:2NaClO3+Na2SO3+H2SO4
2ClO2↑+2Na2SO4+H2O。△
(1)H2C2O4可代替Na2SO3制備ClO2,該反應的化學方程式為,該方法中最突出的優點是。
(2)為了便于運輸和貯存,常將ClO2制備成NaClO2固體。某興趣小組通過如圖所示裝置對其進行制備、收集、吸收并制取NaClO2。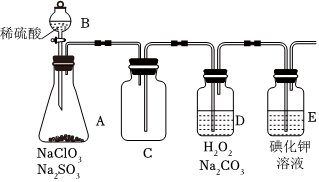
①圖中裝置有一明顯錯誤,請指出:。
②打開B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3寫出D中所發生反應的離子方程式:。
③E中溶液出現黃色不能說明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,可能的原因是:。
④E裝置吸收逸出的少量ClO2氣體后所得溶液(pH為5.5~6.5)中存在少量,當pH≤2時,ClO-2能被I-還原。請補充完整檢驗E裝置溶液中存在少量ClO-2的實驗方案:取一定體積E裝置中的溶液于分液漏斗中,ClO-2,則溶液中存在。(實驗中須使用的試劑有:CCl4、稀硫酸、淀粉溶液)ClO-2組卷:1引用:1難度:0.6 -
18.頁巖氣中含有CH4、CO2、H2S等氣體,是蘊藏于頁巖層可供開采的天然氣資源。頁巖氣的有效利用需要處理其中所含的CO2和H2S。
Ⅰ.CO2的處理:
(1)CO2和CH4重整可制合成氣(主要成分為CO、H2)。已知下列熱化學反應方程式:
C(s)+2H2(g)═CH4(g);ΔH=-74.5kJ?mol-1
CO(g)+H2O(g)═CO2(g)+H2(g);ΔH=-40.0kJ?mol-1
C(s)+H2O(g)═CO(g)+H2(g);ΔH=+132.0kJ?mol-1
反應CO2(g)+CH4(g)═2CO(g)+2H2(g)的ΔH=kJ?mol-1。
(2)Ni催化CO2加H2形成CH4,其歷程如圖1所示(吸附在催化劑表面的物種用*標注),反應相同時間,含碳產物中CH4的百分含量及CO2的轉化率隨溫度的變化如圖2所示。
①260℃時生成主要產物所發生反應的化學方程式為。
②溫度高于320℃,CO2的轉化率下降的原因是。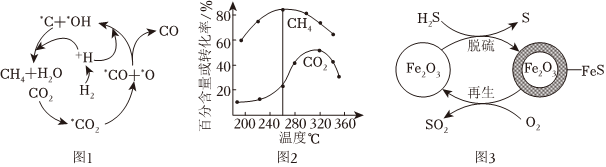
Ⅱ.H2S的處理:Fe2O3可用作脫除H2S氣體的脫硫劑。Fe2O3脫硫和Fe2O3再生的可能反應機理如圖3所示。
(3)Fe2O3脫硫劑的脫硫和再生過程可以描述為。
(4)再生時需控制通入O2的濃度和溫度。400℃條件下,氧氣濃度較大時,會出現脫硫劑再生時質量增大,且所得再生脫硫劑脫硫效果差,原因是。
(5)脫硫劑再生時可以使用水汽代替O2。700℃條件下,用水汽代替O2再生時,生成Fe3O4、H2S和H2,Fe3O4也可作脫硫劑。
①寫出水汽作用條件下脫硫劑再生反應的化學方程式:。
②用O2再生時會生成污染性氣體SO2,用水汽再生時會排放出有毒的H2S,采用O2和水汽混合再生的方法,可以將產生的SO2和H2S轉化為S單質。則為不排放出SO2和H2S,理論上O2和水汽的體積比應為。組卷:137引用:6難度:0.6


