2021-2022學年山東省濟寧市兗州區高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題目要求。
-
1.化學與人類生活、生產和社會可持續發展密切相關,下列有關敘述不正確的是( )
A.華為繼首款搭載了麒麟980芯片5G手機之后,又自主研發了7nm芯片,芯片的主要成分為晶體硅 B.免洗手消毒液主要成分為乙醇,能殺死新型冠狀病毒 C.汽車遠程照燈在前方揚塵上有光亮的通路,說明混有揚塵的空氣屬于膠體 D.納米鐵粉可以高效地除去被污染水體中的Pb2+、Cu2+、Cd2+、Hg2+等重金屬離子,其本質是納米鐵粉對重金屬離子有較強的物理吸附作用 組卷:4引用:3難度:0.8 -
2.“輕軌電車”是重慶一道美麗的風景線。當電車啟動時,電車電刷跟導線的接觸點由于摩擦會產生高溫,因此接觸點上的材料應該具有耐高溫、能導電且化學性質穩定的特點。該接觸點上材料的選用較為合適的是( )
A.金剛石 B.鋁 C.石墨 D.鈉 組卷:9引用:4難度:0.6 -
3.用如圖所示實驗裝置(部分夾持裝置略去)進行相應的實驗,能達到實驗目的的是( )

A.用圖Ⅰ裝置配制100mL0.1mol?L-1的稀硫酸 B.利用裝置Ⅱ合成氨并檢驗氨的生成 C.用如圖Ⅲ裝置制備Fe(OH)2 D.利用裝置Ⅳ制取二氧化硫 組卷:5引用:2難度:0.5 -
4.2021年6月11日國家航天局公布了由“祝融號”火星車拍攝的首批科學影像圖。火星氣體及巖石中富含X、Y、Z、W四種元素。已知:X、Y、Z、W為原子序數遞增的四種短周期元素,其中Z為金屬元素,其單質與熱水反應后溶液能使酚酞試液變為淺紅色,X、W為同一主族元素,Y也是地球地殼中含量最高的元素,火星巖石含有:ZWY3。下列判斷不正確的是( )
A.W位于元素周期表第三周期ⅣA族 B.X、W簡單氫化物的沸點:X<W C.火星氣體中可能含有XY、XY2 D.原子半徑:r(Z)>r(W)>r(Y)>r(X) 組卷:25引用:6難度:0.5 -
5.肼(N2H4)是發射航天飛船常用的高能燃料,可通過反應2NH3+NaClO═N2H4+NaCl+H2O制備。下列有關微粒的描述錯誤的是( )
A.N2H4的結構式為 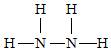
B.NaClO的電子式為Na+[O—Cl]- C.Na+的結構示意圖: 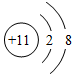
D.中子數為18的氯的核素: Cl3517組卷:45引用:6難度:0.6 -
6.C、Si、S、N都是自然界中含量豐富的非金屬元素,下列有關說法中正確的是( )
A.四種元素在自然界中既有游離態又有化合態 B.二氧化物都屬于酸性氧化物,都能與堿反應而不能與任何酸反應 C.最低價的氣態氫化物都具有還原性,一定條件下都能與O2發生反應 D.氮的氧化物相互轉化都是氧化還原反應 組卷:93引用:4難度:0.5 -
7.硫代硫酸鈉溶液常用于氯氣泄漏的噴灑劑,具有非常好的處理效果,其與氯氣能發生反應:Na2S2O3+4Cl2+5H2O═2NaCl+6HCl+2H2SO4.下列說法錯誤的是( )
A.Na2S2O3在該反應中作還原劑 B.處理氯氣時當Na2S2O3過量時,噴灑后的溶液中會出現渾濁的現象 C.1molNa2S2O3與氯氣完全反應轉移電子4mol D.氧化產物與還原產物的物質的量之比為1:4 組卷:19引用:4難度:0.8
三、非選擇題:本題共6小題,共60分。
-
 20.如表列出了第三周期的幾種元素的部分性質:
20.如表列出了第三周期的幾種元素的部分性質:
請按要求回答下列問題:元素編號 a b c d e 電負性 3.0 2.5 X 1.5 0.9 主要化合價 -1,+7 -2,+6 -3,+5 +3 +1
(1)寫出基態a原子的價層電子軌道表示式:。
(2)表中元素原子半徑最大的是(寫元素符號)。預測X值的區間。
(3)a、b、c三種元素形成的氫化物中,其穩定性由強到弱的順序是(用化學式表示)。
(4)d、e最高價氧化物對應水化物相互反應的離子方程式為。
(5)上表中五種元素的第一電離能由大到小的順序是(寫元素符號)。
(6)某化學興趣小組為探究元素性質的遞變規律,設計了以下系列實驗。
①甲同學為探究同主族元素金屬性的遞變規律,取綠豆粒大小的鈉、鉀分別放入到盛有20mL水的燒杯(滴有幾滴酚酞溶液)中,通過觀察現象得出的結論是。
②乙同學利用現有藥品:Na2S溶液、KMnO4固體、濃鹽酸、MnO2,設計如圖裝置探究第三周期部分元素非金屬性的遞變規律。M中所裝藥品為,裝置N中的實驗現象為有淡黃色沉淀生成,離子方程式為:;所得結論為。組卷:18引用:3難度:0.7 -
21.鈰、鉻、鈦、鎳雖不是中學階段常見的金屬元素,但在工業生產中有著重要作用.
(1)二氧化鈰 (CeO2)在平板電視顯示屏中有著重要應用.CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在該反應中作劑.
(2)自然界Cr主要以+3價和+6價存在.+6價的Cr能引起細胞的突變,可以用亞硫酸鈉將其還原為+3價的鉻.完成并配平下列離子方程式:Cr2O72-+SO32-+=Cr3++SO42-+H2O
(3)鈦(Ti)被譽為“二十一世紀的金屬”,工業上在550℃時用鈉與四氯化鈦反應可制得鈦,該反應的化學方程式是.
(4)NiSO4?xH2O是一種綠色易溶于水的晶體,廣泛用于鍍鎳、電池等,可由電鍍廢渣(除鎳外,還含有銅、鋅、鐵等元素)為原料獲得.操作步驟如下:
①向濾液Ⅰ中加入FeS是為了除去Cu2+、Zn2+等雜質,除去Cu2+的離子方程式為.
②對濾液Ⅱ先加H2O2再調pH,調pH的目的是.
③濾液Ⅲ溶質的主要成分是NiSO4,加Na2CO3過濾后,再加適量稀硫酸溶解又生成NiSO4,這兩步操作的目的是.
④為測定NiSO4?xH2O晶體中x的值,稱取26.3g晶體加熱至完全失去結晶水,剩余固體15.5g,列式計算x的值等于.組卷:13引用:3難度:0.5


