2020-2021學年浙江省寧波市高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(本大題共25小題,每小題2分,共50分。)
-
1.寧波市將居民生活垃圾分為四類垃圾,其中廢舊的鉛蓄電池屬于( )
A.有害垃圾 B.可回收垃圾 C.廚余垃圾 D.其他垃圾 組卷:1引用:1難度:0.6 -
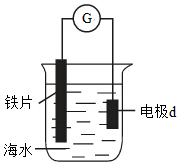 2.研究電化學腐蝕及防護的裝置如圖所示.下列有關說法錯誤的是( )
2.研究電化學腐蝕及防護的裝置如圖所示.下列有關說法錯誤的是( )A.d為石墨,鐵片腐蝕加快 B.d為石墨,石墨上電極反應為:O2+2H2O+4e-=4OH- C.d為鋅塊,鐵片不易被腐蝕 D.d為鋅塊,鐵片上電極反應為:2H++2e-→H2↑ 組卷:3163引用:74難度:0.9 -
3.下列物質溶于水后溶液顯堿性的是( )
A.NaHSO4 B.H3PO4 C.NaF D.NH4Cl 組卷:1引用:1難度:0.7 -
4.可逆反應N2+3H2?2NH3的正、逆反應速率可用各反應物和生成物濃度的變化來表示.下列各關系中能說明反應已達到平衡狀態的是( )
A.3v正(N2 )=v正(H2 ) B.v正(N2 )=v逆(NH3) C.2v正(H2 )=3v逆(NH3) D.v正(N2 )=3v逆(H2 ) 組卷:66引用:11難度:0.9 -
5.室溫下,下列事實不能說明NH3?H2O為弱電解質的是( )
A.0.1mol?L-1NH3?H2O的pH小于13 B.0.1mol?L-1NH4Cl溶液的pH小于7 C.0.1mol?L-1NH3?H2O能使無色酚酞試液變紅色 D.相同條件下,濃度均為0.1mol?L-1NaOH溶液和氨水,氨水的導電能力弱 組卷:10引用:3難度:0.7 -
6.已知“凡氣體分子總數增多的反應一定是熵增大的反應”。根據所學知識判斷,下列反應中,在較高溫度下才能自發進行的是( )
A.2O3(g)═3O2(g)△H<0 B.2CO(g)═2C(s)+O2(g)△H>0 C.N2(g)+3H2(g)═2NH3(g)△H<0 D.CaCO3(s)═CaO(s)+CO2(g)△H>0 組卷:73引用:5難度:0.6 -
7.下列說法不正確的是( )
A.將KCl溶液從常溫加熱至80℃,溶液的pH變小但仍保持中性 B.中和pH和體積均相等的氨水、NaOH溶液,所需HCl的物質的量相同 C.相同溫度下,pH相等的鹽酸、CH3COOH溶液中,c(OH-)相等 D.氨水和鹽酸反應后的溶液,若溶液呈中性,則c(Cl?)=c(NH4+) 組卷:2引用:1難度:0.5 -
 8.機動車使用的鉛蓄電池構造如圖所示,其電池反應的方程式為:Pb+PbO2+2H2SO4═2PbSO4+2H2O。電池工作時,下列說法不正確的是( )
8.機動車使用的鉛蓄電池構造如圖所示,其電池反應的方程式為:Pb+PbO2+2H2SO4═2PbSO4+2H2O。電池工作時,下列說法不正確的是( )A.鉛電極的電極反應式:Pb-2e-+SO42-═PbSO4 B.鉛作負極 C.電子從鉛電極經硫酸流向二氧化鉛電極 D.二氧化鉛發生還原反應 組卷:14引用:1難度:0.6 -
 9.關于化學反應的說法不正確的是( )
9.關于化學反應的說法不正確的是( )A.化學反應中有物質變化也有能量變化 B.需要加熱的化學反應不一定是吸熱反應 C.如圖所示的反應為放熱反應 D.化學鍵斷裂吸收能量 組卷:6引用:2難度:0.8
二、非選擇題(本大題共4小題,共50分)
-
28.(1)比較電離出H+能力的相對強弱:CH3COOH
H2O(填“>、“<”或“=”),用一個離子方程式說明CH3COO?和OH?結合H+能力的相對強弱:。
(2)25℃時,0.1mol?L-1某酸的電離度為0.01%,則pH為。
(3)25℃時,某酸溶液中由水電離產生的c(H+)=1×10-10mol?L-1,則該溶液的pH是。
(4)已知某溫度下1mol/L的醋酸的電離度為0.4%,其電離常數約為。
(5)25°C時,某一元強堿的pH為a,某一元強酸的pH為b,若將1體積的此強堿溶液與10體積的強酸溶液混合,恰好為中性,則a和b的和為。組卷:4引用:1難度:0.5 -
29.研究NOx之間的轉化具有重要意義。
(1)對2NO2(g)?N2O4(g)的研究(以下選擇題有1或2個正確答案)
①已知:2NO2(g)?N2O4(g)ΔH<0,在測定NO2的相對分子質量時,下列條件中,測定結果誤差最小的是。
A.溫度0℃、壓強50kPa
B.溫度130℃、壓強300kPa
C.溫度25℃、壓強100kPa
D.溫度130℃、壓強50kPa
②將一定量NO2氣體充入恒溫恒壓的密閉容器中,下列不可以作為2NO2(g)?N2O4(g)達到平衡的判據是。
A.NO2的體積分數不變
B.氣體的總濃度不變
C.容器內氣體的密度不變
D.氣體平均分子量不變
③在恒溫恒容下,下面一定能提高NO2平衡轉化率的有。
A.加入催化劑
B.容器壓強增大
C.通入NO2(g)
D.通入N2O4
(2)對2NO(g)+O2(g)?2NO2(g)的研究如圖1所示,隔板I固定不動,活塞Ⅱ可自由移動,M、N兩個容器均發生如下應:2NO(g)+O2(g)?2NO2(g)。
①向M、N中各通入2molNO和1molO2,初始M、N容積相同,并保持溫度不變,則到達平衡時NO的轉化率α(NO)Mα(NO)N,(填“>、“<”或“=”)。
②若在某件下,反應2NO(g)+O2(g)?2NO2(g),在容器N中達到平衡,測得容器中含有NO1.0mol,O20.4mol,NO21.0mol,此時容積為2.0L。則此條件下的平衡常數為;保持溫度和壓強不變,向此容器內通入0.6molO2,平衡將(填“正向”、“逆向”或“不”)移動,請從濃度熵與K角度寫出簡要的推理過程。
③NO氧化反應:2NO(g)+O2(g)?2NO2(g)按以下兩步連續基元反應進行,其反應過程能量變化示意圖如圖2。已知基元反應的速率都隨溫度的升高而增大,Ea表示活化能。
Ⅰ2NO(g)?N2O2(g)ΔH1<0
ⅡN2O2(g)+O2(g)?2NO2(g)ΔH2<0
升高溫度絕大多數的化學反應速率增大,但是該反應的速率卻隨溫度的升高而減小。對于連續反應,反應速率有慢反應速率決定,請從活化能的角度分析決定NO氧化反應速率的步驟是(填“Ⅰ”或“Ⅱ”)。
試結合反應過程能量圖(圖2)利用反應速率和平衡移動原理,從溫度和反應物濃度兩個角度分析慢反應速率隨溫度升高而降低的原因。組卷:15引用:1難度:0.4


