2022-2023學年浙江省杭州市“六縣九校”聯(lián)考高二(下)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本大題共25小題,每小題只有一個正確選項,每題2分,共50分)
-
1.水溶液呈酸性的鹽是( )
A.NH4Cl B.Na2CO3 C.H2SO4 D.Ca(OH)2 組卷:44引用:1難度:0.8 -
2.下列物質屬于強電解質的是( )
A.CH3COOH B.Fe C.KNO3 D.C2H2 組卷:19引用:1難度:0.6 -
3.下列儀器和名稱都正確的是( )
A. 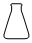
燒瓶B. 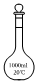
溶量瓶C. 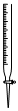
堿式滴定管D. 
坩堝組卷:13引用:1難度:0.8 -
4.下列物質對應的化學式不正確的是( )
A.小蘇打:NaHCO3 B.光導纖維的主要成分:Si C.膽礬:CuSO4?5H2O D.漂白粉的有效成分:Ca(ClO)2 組卷:4引用:1難度:0.6 -
5.下列化學用語表示正確的是( )
A.質量數(shù)為37的氯原子: Cl3720B.基態(tài)Mn2+的價電子軌道表示式: 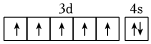
C.氯化鈣的電子式: 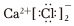
D.Cl-C的p-pσ鍵電子云圖形:  組卷:7引用:1難度:0.5
組卷:7引用:1難度:0.5 -
6.下列說法不正確的是( )
A.淀粉和纖維素都可用于生產乙醇 B.天然油脂的主要成分是高級脂肪酸甘油酯,它屬于高分子化合物 C.重金屬鹽能使蛋白質變性,但吞服鋇餐(BaSO4)不會引起中毒 D.多糖、油脂、蛋白質在一定條件下都能發(fā)生水解反應 組卷:127引用:1難度:0.5 -
7.用VSEPR模型預測下列分子或離子的立體結構,其中正確的是( )
A.H2O與BeCl2為角形(V形) B.CS2與SO2為直線形 C.BF3與PCl3為三角錐形 D.SO3與CO32-為平面三角形 組卷:632引用:14難度:0.5 -
8.物質的性質決定用途,下列兩者對應關系不正確的是( )
A.Fe2O3紅色,可用作顏料 B.NaClO溶液呈堿性,可用作消毒劑 C.白醋具有弱酸性,可用作清洗水壺中的水垢 D.可用含氫氧化鈉的氫氧化銅懸濁液反應來檢驗病人尿液中葡萄糖含量是否偏高 組卷:17引用:1難度:0.5 -
9.下列說法正確的是( )
A.I2易溶于CCl4可以用“相似相溶”原理解釋 B.CH4、CCl4都是含有極性鍵的極性分子 C.由于甲基(-CH3)的推電子效應,HCOOH的酸性小于CH3COOH的酸性 D. 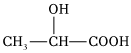 分子中無手性碳原子組卷:38引用:1難度:0.8
分子中無手性碳原子組卷:38引用:1難度:0.8
二、非選擇題(共有4個小題,共50分)
-
 28.用CO2轉化為乙醇可實現(xiàn)碳循環(huán)。近年來,隨著全球變暖及能源枯竭的加劇,由CO2制乙醇又再次成為各國的研究熱點。
28.用CO2轉化為乙醇可實現(xiàn)碳循環(huán)。近年來,隨著全球變暖及能源枯竭的加劇,由CO2制乙醇又再次成為各國的研究熱點。
Ⅰ.CO2轉化為乙醇的一種途徑如下:2CO2(g)+2H2O(g)?C2H4(g)+3O2(g)ΔH1=+1323kJ?mol-1
C2H4(g)+H2O(g)?C2H5OH(l)ΔH2=-88.2kJ?mol-1
H2O(g)═H2O(l)ΔH3=-44kJ?mol-1
(1)則2CO2(g)+3H2O(l)?C2H5OH(l)+3O2(g)ΔH=kJ?mol-1。
Ⅱ.已知CO2催化加氫制乙醇原理為2CO2(g)+6H2(g)?C2H5OH(g)+3H2O(g),回答下列問題:
(2)在恒溫恒容的密閉容器中,對CO2催化加氫制乙醇反應體系說法不正確的是。(填序號)
A.增大原料氣中的比例,有利于提高CO2的轉化率n(CO2)n(H2)
B.若混合氣體的密度保持不變,說明反應體系已達平衡
C.體系達平衡后,若壓縮容器容積,則反應平衡正向移動
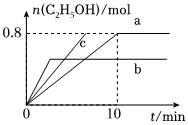
(3)在均為2L的恒容密閉容器a和b中分別投入2molCO2和6molH2,在不同溫度下進行CO2加氫制乙醇的反應,各容器中乙醇的物質的量與時間的關系如圖所示:
①容器a中0~10min氫氣的平均反應速率v(H2)=;
②若容器a、b中的反應溫度分別為T1、T2,則判斷ΔH0(填“>”或“<”);
③若容器a中改變條件時,反應情況會由曲線a變?yōu)榍€c,則改變的單一條件可是(填序號);
A.加入更高效的催化劑
B.升溫
C.增大壓強
D.分離出乙醇
④T1溫度下反應達平衡時,容器a中氣體總壓強為4MPa,則T1時該反應的平衡常數(shù)Kp=(用平衡分壓代替平衡濃度計算,氣體的分壓=氣體總壓強×氣體的物質的量分數(shù))。組卷:25引用:1難度:0.7 -
29.完成下列問題
Ⅰ.第ⅣA族元素,碳、硅、鍺、錫、鉛具有很多重要的性質。
(1)鍺元素的基態(tài)原子的核外電子排布式為。
(2)單質Sn與干燥的Cl2反應生成SnCl4,常溫常壓下SnCl4為無色液體,SnCl4空間構型為,其固體的晶體類型為。
(3)鹵化硅(SiX4)的沸點和二鹵化鉛(PbX2)的熔點如圖所示。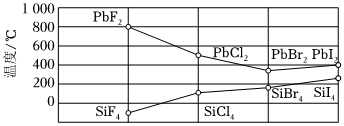
①SiX4的沸點依F、Cl、Br、I次序升高的原因是。
②結合SiX4的沸點和PbX2的熔點變化規(guī)律,可推斷:依F、Cl、Br、I次序,PbX2晶體中離子鍵百分數(shù)(填“增大”“不變”或“減小”)。
Ⅱ.鈹及其化合物的應用正日益被重視。
(4)鈹與相鄰主族的鋁元素性質相似。下列有關鈹和鋁的敘述正確的有。
A.都屬于p區(qū)主族元素
B.電負性都比鎂大
C.第一電離能都比鎂大
D.氯化物的水溶液pH均小于7
(5)氯化鈹在氣態(tài)時存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固態(tài)時則具有如圖所示的鏈狀結構(c)。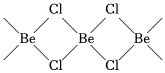
①a屬于(填“極性”或“非極性”)分子;
②二聚分子(BeCl2)2中Be原子的雜化方式相同,且所有原子都在同一平面上,b的結構式為。組卷:23引用:1難度:0.6


