2022-2023學年黑龍江省實驗中學高二(上)期中化學試卷
發布:2024/10/2 11:0:4
一、選擇題(共20小題,1﹣10題每題2分,11﹣20題每題3分,共50分。每題只有一個選項符合題意。)
-
1.化學促進了科技進步和社會發展。下列敘述中沒有涉及化學變化的是( )
A.千錘萬鑿出深山,烈火焚燒若等閑 B.北京冬奧會場館使用CO2跨臨界直冷制冰 C.科學家成功將CO2轉化為淀粉或葡萄糖 D.加入明礬后泥水變澄清 組卷:0引用:1難度:0.8 -
2.在下列各說法中,正確的是( )
A.應用高效潔凈的能源轉換技術,提高能源的利用效率,有利于減少霧霾 B.化學反應中生成物總能量一定低于反應物總能量 C.1molH2SO4與1molBa(OH)2完全反應時放出的熱量為114.6kJ D.破壞生成物全部化學鍵所需要的能量大于破壞反應物全部化學鍵所需要的能量時,該反應一定為吸熱反應 組卷:1引用:1難度:0.7 -
3.在下列變化中,體系的熵減小的是( )
A.硝酸銨溶于水 B.固體碘升華 C.冰融化成水 D.乙烯聚合為聚乙烯 組卷:5引用:1難度:0.7 -
4.下列說法中有明顯錯誤的是( )
A.活化分子之間發生的碰撞不一定為有效碰撞 B.對有氣體參加的化學反應,增大壓強,體系體積減小,可使單位體積內活化分子數增加,因而反應速率增大 C.升高溫度,一般可使活化分子的百分數增大,因而反應速率增大 D.加入適宜的催化劑,使分子能量增加從而可使活化分子的百分數大大增加,從而增大化學反應速率 組卷:37引用:2難度:0.7 -
5.在一密閉容器中充入一定量的N2和H2,發生反應N2(g)+3H2(g)?2NH3(g)ΔH=-92.6kJ/mol,經測定反應開始后的2s內氫氣的平均反應速率為:v(H2)=0.30mol/(L?s),則2s末NH3的濃度為( )
A.0.30mol?L-1 B.0.40mol?L-1 C.0.45mol?L-1 D.0.55mol?L-1 組卷:13引用:1難度:0.8 -
6.在CH3COOH?H++CH3COO-形成的平衡中,要使CH3COOH的電離程度及c(H+)都增大,可采取的措施是( )
A.通入HCl B.加少量NaOH固體 C.升溫 D.加水 組卷:4引用:1難度:0.6 -
7.25℃時,HF的下列性質中,可以證明它是弱電解質的是( )
A.HF能與水以任意比例互溶 B.0.1mol/LHF溶液的pH值約為3 C.HF與SiO2發生反應 D.10mL1mol/LHF恰好與10mL1mol/LNaOH溶液完全反應 組卷:1引用:1難度:0.7 -
8.下列實驗基本操作正確的是( )
A.用堿式滴定管量取0.10 mol?L-1的Na2CO3溶液22.10 mL B.配制一定濃度的氫氧化鈉溶液時,將氫氧化鈉固體放在紙片上稱量 C.用廣泛pH試紙測某 溶液PH=3.6 D.用玻璃棒蘸取溶液滴到濕潤的pH試紙上,測其pH 組卷:23引用:3難度:0.9
二、填空題(共50分)
-
23.食醋是日常飲食中的一種調味劑,國家標準規定釀造食醋中醋酸含量不得低于3.5g/100mL。用中和滴定的方法可以測定食醋中醋酸的濃度。某白醋的醋酸濃度測定過程如圖所示:
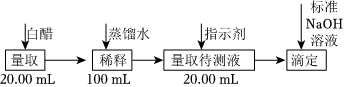
完成下列填空:
(1)量取20.00mL待測液放入錐形瓶中,并滴加2~3滴作指示劑,用0.1000mol/LNaOH標準溶液進行滴定,滴定前排氣泡時,應選擇圖中的(填字母)。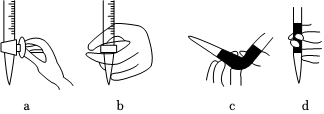
(2)滴定時,左手控制滴定管,右手搖動錐形瓶,眼睛注視;滴定達到終點的標志是。
(3)某同學一共進行了四次實驗,以下是他的實驗數據記錄表。
數據處理:根據上表數據計算稀釋后白醋的濃度為實驗次數 稀釋后白醋體積(mL) 標準NaOH溶液 滴定前讀數 滴定后讀數 1 20.00 1.05 21.45 2 20.00 1.05 24.45 3 20.00 1.00 24.45 3 20.00 0.60 23.95 mol?L-1,則該白醋(選填“符合”或“不符合”)國家標準,原因是。
(4)在上述實驗中,下列操作(其他操作正確)會造成測定結果偏高的有。
A.酸式滴定管水洗后未用待測白醋溶液潤洗
B.滴定前用待測白醋溶液潤洗錐形瓶
C.堿式滴定管尖嘴部分有氣泡,滴定后消失
D.滴定終點讀數時俯視讀數組卷:75引用:1難度:0.5 -
24.“綠水青山就是金山銀山”,氮氧化物是造成大氣污染的主要物質。研究氮的氧化物反應機理對于消除環境污染有重要意義。汽車尾氣中的CO、NOx、碳氮化合物是大氣污染物。使用稀土等催化劑能將CO、NO轉化成無毒物質。
(1)已知:C(s)+O2(g)═CO2(g)ΔH1=-393.5kJ/mol
2C(s)+O2(g)═2CO(g)ΔH2=-221kJ/mol
N2(g)+O2(g)═2NO(g)ΔH3=+180kJ/mol
計算2NO(g)+2CO(g)═2CO2(g)+N2(g)ΔH=kJ/mol。
(2)氣體NO2與CO在一定條件下的反應為:2NO2(g)+4CO(g)?4CO2(g)+N2(g)ΔH=-1200kJ/mol。
①某溫度下,在2L密閉容器中充入0.2molNO2和0.4molCO,此時容器的壓強為P,5s時反應達到平衡狀態,此時測得容器的壓強變為原來的,則反應開始到平衡時NO2的平均反應速率v(NO2)=1112mol/(L?s)。
②若此溫度下,某時刻測得NO2、CO、CO2、N2的濃度分別為0.1mol/L、0.4mol/L、0.4mol/L、0.06mol/L,該時刻反應向反應方向進行(填正、逆或不移動),原因是。
(3)NO與Cl2在一定條件下發生反應生成亞硝酰氯,反應原理為:2NO(g)+Cl2(g)?2ClNO(g);現向密閉容器中通入0.08molNO和0.04molCl2,上述反應在不同壓強、溫度條件下NO轉化率變化關系如圖: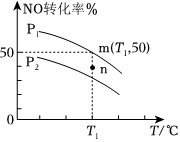
①該反應ΔH0(填“>”“<”或“不確定”);P1P2(填“>”“<”或“不確定”)。
②壓強為P2、溫度為T1℃進行該實驗,某時刻n點v(正)v(逆)(填“>”“<”或“不確定”)。
③m點時NO轉化率為50%,測得容器內總壓強為100MPa,計算平衡時該反應的壓強平衡常數Kp=。(Kp是用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)組卷:10引用:1難度:0.6


