2021-2022學年河北省邯鄲市匯文中學高二(上)期中化學試卷
發布:2024/11/17 8:30:1
一、選擇題:本題共9小題,每小題3分,共27分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.古籍中記載:陽遂金也,取金盂無緣者,執日高三四丈時,以向,持燥艾承之寸馀,有頃焦之,吹之則燃得火。上述記載中是古人對哪種能量的利用( )
A.風能 B.水能 C.太陽能 D.地熱能 組卷:21引用:5難度:0.8 -
2.下列物質溶于水能促進水的電離的是( )
A.NH3 B.BaCl2 C.H2S D.FeCl3 組卷:26引用:7難度:0.7 -
3.在一密閉容器中,存在可逆反應8NH3(g)+3Cl2(g)?6NH4Cl(s)+N2(g),該反應的平衡常數表達式為( )
A.K= c8(NH3)×c3(Cl2)c6(NH4Cl)×c(N2)B.K= c(NH3)×c(Cl2)c(N2)C.K= c(N2)c8(NH3)×c3(Cl2)D.K= c(NH4Cl)×c(N2)c(NH3)×c(Cl2)組卷:76引用:6難度:0.7 -
4.下列物質的電離方程式或水解方程式書寫正確的是( )
A.HCN ═H++CN-B.SO32-+2H2O?H2SO3+2OH- C.HCO3-+H2O?H3O++CO32- D.Al2(SO4)3?2Al3++3SO42- 組卷:19引用:8難度:0.6 -
5.升高溫度,下列物理量不一定增大的是( )
A.化學反應平衡常數K B.水的離子積常數Kw C.化學反應速率v D.KNO3的溶解度S 組卷:20引用:5難度:0.6
三、非選擇題:本題共4小題,共57分。
-
16.當今,世界各國相繼規劃了碳達峰、碳中和的時間節點.因此,研發CO2利用技術、降低CO2含量成為研究熱點.某化學實驗小組采用CO2催化加氫制甲醇來減少CO2對環境造成的影響.在容積為4L的恒容密閉容器中,充入2.4mol H2和1.2mol CO2,發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.回答下列問題:
(1)每消耗0.3mol H2,該反應放出的熱量為kJ.
(2)下列能用來判斷該反應達到平衡狀態的標志是(填標號).
A.混合氣體的密度不再隨時間改變
B.混合氣體的平均相對分子質量不再隨時間改變
C.c(CH3OH)不再隨時間改變
D.混合氣體的質量不再隨時間改變
(3)3min后,反應達到平衡狀態,此時測得反應前后的總壓強之比為5:4.
①c(CO2)=mol?L-1,H2的轉化率為%.
②v(H2O)=mol?L-1?min-1.
③該反應達到平衡時的平衡常數K=(列出計算式即可)mol-2?L2.
(4)在一定條件下,體系中的CO2的平衡轉化率(α)與溫度(T)和壓強(p)的關系如圖所示.則T1(填“>”或“<”)T2,判斷的理由是.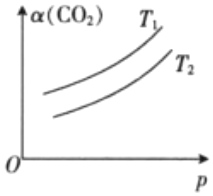 組卷:6引用:4難度:0.4
組卷:6引用:4難度:0.4 -
17.煙氣中的SO2會給環境和人體健康帶來極大的危害,工業上采取多種方法減少這些有害氣體的排放。回答下列問題:
方法1(雙堿法):用NaOH吸收SO2,并用CaO使NaOH再生,即NaOH溶液=Na2SO3溶液。過程①過程②
(1)過程①的離子方程式為。
(2)常溫下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收過程中水的電離平衡(填“向左”“向右”或“不”)移動。該溶液中由水電離出的c(H+)=mol?L-1;NaHSO3溶液顯(填“酸”、“堿”或“中”)性。(常溫下H2SO3的電離平衡常數Ka1=1.4×10-2,Ka2=6.0×10-8)
(3)CaO在水中存在如下轉化:CaO(s)+H2O(l)═Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)。從平衡移動的角度,簡述過程②NaOH再生的原理。
(4)理論上,該工藝中NaOH只作為啟動堿,實際主要消耗的是生石灰。實際吸收過程中,由于存在一定氧氣,會發生副反應:(填化學方程式),因副產物(填化學式)在工藝中較難循環再生成NaOH,需要不斷向系統中補充NaOH。
方法2:用氨水除去SO2。
(5)已知常溫時NH3?H2O的Kb=1.8×10-5,若氨水的濃度為2.0mol?L-1,溶液中c(OH-)=mol?L-1。將SO2通入該氨水中,當溶液恰好呈中性時,溶液中=c(SO32-)c(HSO3-)。組卷:5引用:2難度:0.6


