2023-2024學年北京交大附中高二(上)期中化學練習試卷
發布:2024/10/2 5:0:2
一、選擇題(每小題只有一個選項符合題意,本題共14小題,每小題3分,共42分)
-
1.下列裝置或過程能實現電能轉化為化學能的是( )

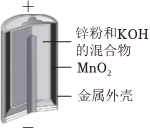
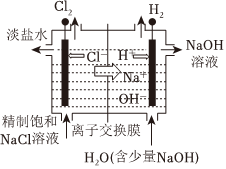
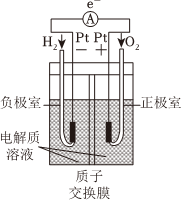
A.火力發電 B.堿性鋅錳電池 C.電解飽和食鹽水 D.氫氧燃料電池 A.A B.B C.C D.D 組卷:37引用:3難度:0.7 -
2.下列說法正確的是( )
A.放熱反應一定是自發反應 B.熵增的反應不一定是自發反應 C.固體溶解一定是熵減小的過程 D.非自發反應在任何條件下都不能發生 組卷:312引用:13難度:0.8 -
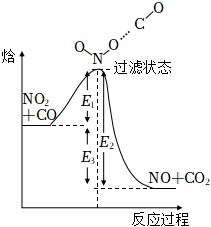 3.如圖所示為某基元反應過程的能量變化(E1、E2、E3均大于0)。下列說法正確的是( )
3.如圖所示為某基元反應過程的能量變化(E1、E2、E3均大于0)。下列說法正確的是( )A.該反應的正反應為吸熱反應 B.E1+E3為該反應的活化能 C.圖中對應的該反應的焓變ΔH=-E2 D.NO2和CO分子發生有效碰撞才能形成過渡狀態分子 組卷:83引用:7難度:0.7 -
4.一定溫度下,在2個容積均為10L的恒容密閉容器中,加入一定量的反應物,發生反應:H2(g)+I2(g)?2HI(g),充分反應并達到化學平衡狀態,相關數據見下表。下列說法正確的是( )
容器編號 起始時各物質的物質的量/mol 平衡時I2的濃度/(mol?L-1) n(H2) n(I2) n(HI) c(I2) Ⅰ 0.1 0.1 0 0.008 Ⅱ 0.2 0.2 0 x A.該溫度下,反應的化學平衡常數K=0.25 B.Ⅱ中x=0.008 C.容器內氣體的密度不再改變可以作為反應達到化學平衡狀態的標志 D.反應開始階段的化學反應速率:Ⅰ>Ⅱ 組卷:76引用:7難度:0.4 -
5.化學小組研究金屬的電化學腐蝕,實驗如下:
下列說法不正確的是( )序號 實驗Ⅰ 實驗Ⅱ 實驗 

現象 鐵釘周邊出現______色
鋅片周邊未見明顯變化鐵釘周邊出現藍色
銅片周邊略顯紅色A.實驗Ⅰ中鐵釘周邊出現紅色 B.實驗Ⅰ中負極的電極反應式:Fe-2e-═Fe2+ C.實驗Ⅱ中正極的電極反應式:O2+2H2O+4e-═4OH- D.對比實驗Ⅰ、Ⅱ可知,生活中鍍鋅鐵板比鍍銅鐵板在鍍層破損后更耐腐蝕 組卷:211引用:6難度:0.5 -
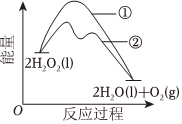 6.已知1molH2O2分解放出熱量98kJ。在含有少量I-的溶液中,H2O2分解的機理是:ⅰ.H2O2+I-═H2O+IO-,ⅱ.H2O2+IO-═H2O+O2↑+I-。H2O2分解過程中能量變化如圖。下列說法正確的是( )
6.已知1molH2O2分解放出熱量98kJ。在含有少量I-的溶液中,H2O2分解的機理是:ⅰ.H2O2+I-═H2O+IO-,ⅱ.H2O2+IO-═H2O+O2↑+I-。H2O2分解過程中能量變化如圖。下列說法正確的是( )A.①表示加催化劑后反應過程中的能量變化 B.①的活化能等于98kJ?mol-1 C.ⅰ和ⅱ均為放熱反應 D.ⅰ的化學反應速率比ⅱ的小 組卷:87引用:5難度:0.5
二、第Ⅱ卷(58分)
-
18.電化學還原CO2將其轉化為其它化學產品,是一種綜合利用CO2的好方法。
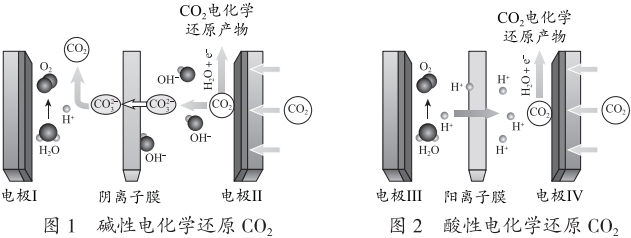
已知:選擇性(S)和法拉第效率(FE)的定義:
S(B)=×100%n(生成B所用的CO2)陰極吸收的CO2
FE(B)=×100%n(生成B所用的電子)n(通過電極的電子)
(1)堿性電化學還原CO2前,先在中性電解液中通電一段時間,pH及電流穩定后,再通CO2。在陰極區若CO2每得到1mol電子,同時H2O也會得到等物質的量的電子,且陰極區電解液的pH幾乎保持不變(忽略溶液體積變化)。
①補全陰極產生CH4的電極反應:CO2++═CH4+。
②陰極附近因為發生反應(用離子方程式表示),生成的難以放電,降低了S(CH4)。結合上述信息,S(CH4)的理論最大值為CO2-3。
③結合化學用語分析陽極區產生CO2的原因是。
(2)控制pH=1、電解液中存在KCl時,電化學還原CO2過程中CH4(其他含碳產物未標出)和H2的法拉第效率變化如圖3所示。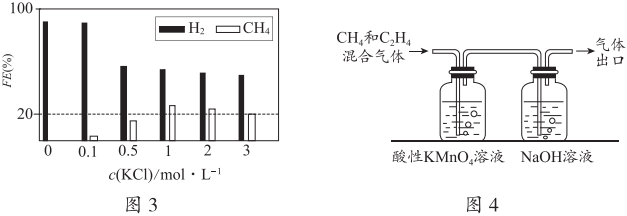
①結合圖3的變化規律,推測KCl可能的作用是。
②c(KCl)=3mol?L-1時,11.2L(已折合為標準狀況,下同)的CO2被完全吸收并還原為CH4和C2H4,分離H2后,將CH4和C2H4混合氣體通入如圖4所示裝置(反應完全),出口處收集到氣體6.72L,則FE(C2H4)為。組卷:103引用:4難度:0.5 -
19.實驗小組對NaHSO3溶液分別與CuCl2、CuSO4溶液的反應進行探究。
已知:實驗 裝置 試劑x 操作及現象
Ⅰ
1 mol?L-1 CuCl2溶液加入2mL CuCl2溶液,得到綠色溶液,30s時有無色氣泡和白色沉淀產生,上層溶液顏色變淺。 Ⅱ 1 mol?L-1 CuSO4溶液 加入2mL CuSO4溶液,得到綠色溶液,3分鐘未見明顯變化。
Ⅰ.Cu2+[Cu(NH3)4]2+(深藍色溶液)濃氨水
Ⅱ.Cu+[Cu(NH3)2]+(無色溶液)濃氨水[Cu(NH3)4]2+(深藍色溶液)露置在空氣中一段時間
(1)推測實驗Ⅰ產生的無色氣體為SO2,實驗證實推測正確:用蘸有碘水的淀粉試紙接近試管口,觀察到,反應的離子方程式為。
(2)對實驗Ⅰ產生SO2的原因進行分析,提出假設:
假設a:Cu2+水解使溶液中c(H+)增大;
假設b:Cl-存在時,Cu2+與反應生成CuCl白色沉淀,溶液中c(H+)增大。HSO-3
①假設a不合理,實驗證據是;
②實驗表明假設b合理,實驗I反應的離子方程式有、H++═SO2↑+H2O。HSO-3
(3)對比實驗Ⅰ、Ⅱ,提出假設:Cl-增強了Cu2+的氧化性。
下述實驗Ⅲ證實了假設合理,裝置如圖。實驗方案:閉合K,電壓表的指針偏轉至“X”處;向U形管(補全實驗操作及現象)。
(4)將實驗Ⅱ的溶液靜置24小時或加熱后,得到紅色沉淀。經檢驗,紅色沉淀中含有Cu+、Cu2+和。SO2-3
①通過實驗Ⅳ證實紅色沉淀中含有Cu+和Cu2+。
實驗Ⅳ: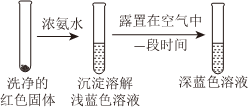
證實紅色沉淀中含有Cu+的實驗證據是;
②有同學認為實驗Ⅳ不足以證實紅色沉淀中含有Cu2+,設計實驗Ⅳ的對比實驗Ⅴ,證實了Cu2+的存在。實驗Ⅴ的方案和現象是:。組卷:105引用:6難度:0.5


