2020-2021學年重慶八中高一(下)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共14個,每小題只有一個正確答案,每小題3分,共42分)
-
1.下列反應屬于吸熱反應的是( )
A.木炭燃燒 B.CaCO3受熱分解 C.Na與水反應 D.鹽酸與NaOH溶液反應 組卷:21引用:5難度:0.7 -
2.銀鋅電池總反應如下,Zn+Ag2O+H2O=Zn(OH)2+2Ag,則該原電池的負極是( )
A.Zn B.Ag C.Zn(OH)2 D.Ag2O 組卷:4引用:1難度:0.5 -
3.下列有關物質組成、性質和用途的說法中,正確的是( )
A.合金的熔點一般比組成合金的各成分金屬的高 B.氮化硅、光導纖維、氧化鋁陶瓷等屬于新型無機非金屬材料 C.水泥、玻璃和水晶都是硅酸鹽產品 D.光導纖維的主要成分是硅,可廣泛用于通信和醫療領域 組卷:23引用:3難度:0.5 -
4.下列物質中,不能由單質直接化合生成的是( )
①CuS ②FeS ③SO3 ④H2S ⑤FeCl2A.①③⑤ B.①②③⑤ C.①②④⑤ D.全部 組卷:205引用:23難度:0.9 -
5.下列五種有色溶液與SO2作用均能褪色,其實質相同的是( )
①品紅溶液;
②酸性KMnO4溶液;
③溴水;
④滴有酚酞的NaOH溶液;
⑤含I2的淀粉溶液.A.①④ B.①②③ C.②③⑤ D.③④ 組卷:51引用:7難度:0.7 -
6.關于中和熱,下列說法正確的是( )
A.在稀溶液中,任何酸與堿發生中和反應生成1molH2O(l)時放出的熱量均為57.3kJ B.測定中和熱過程中,實驗前用溫度計測量NaOH溶液的溫度后,立刻測定鹽酸的溫度 C. H2SO4(aq)+12Ba(OH)2(aq)=12BaSO4(s)+H2O(l),該反應ΔH=-57.3kJ/mol12D.中和熱的測定實驗中,可選擇50mL0.5mol/L稀鹽酸和50mL0.55mol/LNaOH溶液進行實驗 組卷:277引用:5難度:0.7
二、非選擇題(本題共5個小題,共58分)最帕效土合小超宜頁單由不,,中朗啡順不..
-
19.甲、乙兩同學為探究SO2與可溶性鋇的強酸鹽能否反應生成白色BaSO3沉淀,用如圖所示裝置進行實驗(夾持裝置和A中加熱裝置已略,氣密性已檢驗)
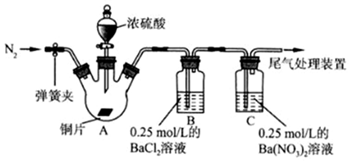
實驗操作和現象:
(1)C中白色沉淀是操作 現象 關閉彈簧夾,滴加一定量濃硫酸,加熱 A中有白霧生成,銅片表面產生氣泡
B中有氣泡冒出,產生大量白色沉淀
C中產生白色沉淀,液面上放略顯淺棕色并逐漸消失打開彈簧夾,通入N2,
停止加熱,一段時間后關閉從B、C中分別取少量白色沉淀,加稀鹽酸 尚未發現白色沉淀溶解 ,該沉淀的生成表明SO2具有性.
(2)C中液面上方生成淺棕色氣體的化學方程式是.
(3)分析B中不溶于稀鹽酸的沉淀產生的原因,甲認為是空氣參與反應,乙認為是白霧參與反應.
①為證實各自的觀點,在原實驗基礎上:
甲在原有操作之前增加一步操作,該操作是;乙在A、B間增加洗氣瓶D,D中盛放的試劑是.
②進行實驗,B中現象:
檢驗白色沉淀,發現均不溶于稀鹽酸.結合離子方程式解釋實驗現象異同的原因:甲 大量白色沉淀 乙 少量白色沉淀 .
(4)合并(3)中兩同學的方案進行試驗.B中無沉淀生成,而C中產生白色沉淀,由此得出的結論是.組卷:32引用:3難度:0.5 -
20.液態肼(N2H4)是一種高能燃料,在工業生產中用途廣泛。其結構如圖1所示:
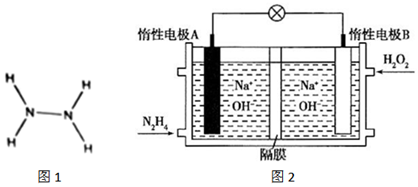
(1)0.5mol肼中含有mol極性共價鍵。
(2)工業上可用肼與新制Cu(OH)2反應制備Cu2O,同時放出N2,該反應的化學方程式為。
(3)N2H4可在O2中燃燒生產N2和水蒸氣,已知,16g肼完全反應放出熱量為267kJ,則肼在氧氣中燃燒的熱化學方程式是;部分共價鍵鍵能如表所示:
則肼中N-N的鍵能是N-H 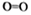

H-O 鍵能(kJ/mol) 391 498 936 463 kJ/mol。
(4)肼-過氧化氫堿性燃料電池由于其較高的能量密度而備受關注,其工作原理如圖所示。該電池的B極區發生(填“氧化反應”或“還原反應”),負極的電極反應為,電池工作過程中,若A極區產生11.2L(標況下)N2,則B極區消耗H2O2的物質的量是mol。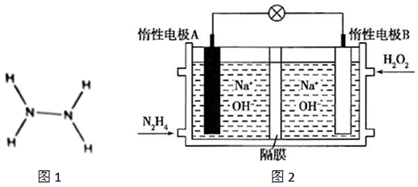 組卷:11引用:2難度:0.6
組卷:11引用:2難度:0.6


