2022-2023學年北京市豐臺區高二(上)期中化學試卷(B卷)
發布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,每小題只有1個符合題意的選項)
-
1.下列裝置或過程能實現化學能轉化為電能的是( )




A.銀鋅紐扣電池 B.冶煉金屬鈉 C.太陽能電池 D.天然氣燃燒 A.A B.B C.C D.D 組卷:7引用:3難度:0.8 -
2.由氫氣和氧氣反應生成18g水蒸氣放出241.8kJ的熱量,則反應:2H2(g)+O2(g)═2H2O(g)的ΔH為( )
A.-483.6kJ?mol-1 B.-241.8kJ?mol-1 C.+483.6kJ?mol-1 D.+241.8kJ?mol-1 組卷:10引用:1難度:0.6 -
3.如圖所示是兩種常見的化學電源示意圖,下列說法不正確的是( )

A.甲電池屬于一次電池 B.甲電池放電時,電子從鋅筒經外電路到石墨電極 C.乙電池的負極反應式為Pb-2e-═Pb2+ D.乙電池充電時將電能轉化為化學能 組卷:169引用:4難度:0.7 -
 4.如圖為以Pt為電極的氫氧燃料電池的工作原理示意圖,稀H2SO4為電解質溶液。下列有關說法不正確的是( )
4.如圖為以Pt為電極的氫氧燃料電池的工作原理示意圖,稀H2SO4為電解質溶液。下列有關說法不正確的是( )A.b電極為電池的正極 B.a極的電極反應式:H2-2e-═2H+ C.電池工作一段時間后,裝置中c(H2SO4)增大 D.若將H2改為等物質的量的CH4,消耗O2的用量增多 組卷:36引用:3難度:0.7 -
5.在298K、100kPa時,已知:2H2O(g)═O2(g)+2H2(g)ΔH1
Cl2(g)+H2(g)═2HCl(g) ΔH2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g) ΔH3
則ΔH3與ΔH1和ΔH2間的關系正確的是( )A.ΔH3=ΔH1-2ΔH2 B.ΔH3=ΔH1+ΔH2 C.ΔH3=ΔH1-ΔH2 D.ΔH3=ΔH1+2ΔH2 組卷:118引用:5難度:0.5 -
6.已知P4(白磷,s)?4P(紅磷,s)ΔH=-17kJ?mol-1,下列推論中正確的是( )
A.正反應是一個吸熱反應 B.白磷比紅磷穩定 C.當1mol白磷完全轉變成紅磷時放出17kJ熱量 D.當4g紅磷轉變成白磷時吸收17kJ熱量 組卷:36引用:2難度:0.8
二、解答題(共5小題,滿分58分)
-
18.氫能是一種極具發展潛力的清潔能源,CH4-H2O催化重整是目前大規模制取氫氣的重要方法。
(1)CH4-H2O催化重整:
反應Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH1=+210kJ?mol-1
反應Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)ΔH2=-41kJ?mol-1
①提高CH4平衡轉化率的條件是。
a.增大壓強
b.加入催化劑
c.增大水蒸氣濃度
②CH4、H2O催化重整生成CO2、H2的熱化學方程式是。
③已知800℃時,反應的平衡常數K=1。該溫度下在1L密閉容器中,將2.0molCO與8.0molH2O混合加熱到反應發生,達到平衡時CO的濃度為,H2O的轉化率為。
(2)實驗發現,其他條件不變,相同時間內,向催化重整體系中投入一定量的CaO可以明顯提高H2的百分含量。做對比實驗,結果如圖所示:
投入CaO時,H2百分含量增大的原因是:。
(3)反應中催化劑活性會因積炭反應而降低,相關數據如下表:
①研究發現,如果反應Ⅰ不發生積炭過程,則反應Ⅱ也不會發生積炭過程。因此,若保持催化劑的活性,可適當采取降溫的方法,請結合表中數據解釋原因反應 Ⅰ Ⅱ CH4(g) C(s)+2H2(g)積碳消碳2CO(g) C(s)+CO2(g)積碳消碳ΔH(kJ?mol-1) +75 -173 。
②如果均發生了Ⅰ、Ⅱ的積炭反應,通入過量水蒸氣能有效清除積炭,反應的化學方程式是。組卷:13引用:3難度:0.5 -
19.利用電化學方法可以將CO2有效地轉化為HCOO-(其中C元素的化合價為+2價),裝置如圖1所示。
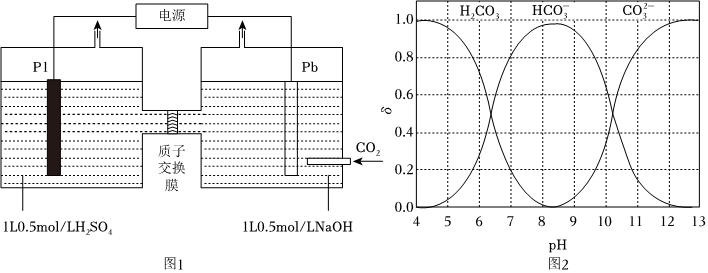
(1)在該裝置中,左側Pt電極為。(填“陰極”或“陽極”)
(2)裝置工作時,陰極除有HCOO-生成外,還可能生成副產物降低電解效率。
已知:電解效率=。一段時間內生成目標產物轉移電子數一段時間內電解池轉移電子總數
①副產物可能是。(寫出一種即可)
②標準狀況下,當陽極生成氧氣體積為224mL時,測得整個陰極區內的c(HCOO-)=0.017mol/L,電解效率為。(忽略電解前后溶液的體積變化)
(3)研究表明,溶液pH會影響CO2轉化為HCOO-的效率。圖2是CO2(以H2CO3計) 在水溶液中各種存在形式的物質的量分數δ隨pH變化的情況。
①pH>12時,CO2幾乎未轉化為HCOO-,此時CO2在溶液中的主要存在形式為。
②pH=8.5時,CO2的轉化效率較高,溶液中相應的電極反應式為。有人認為,在此條件下裝置工作一段時間后,陰極附近溶液的pH幾乎不發生變化(忽略電解前后溶液的體積變化)。你是否同意他的觀點,并請說明理由:。組卷:52引用:3難度:0.5


