2018-2019學年福建省龍巖一中高一(上)第一次模塊化學試卷
發布:2024/4/20 14:35:0
一、選擇題(50分)本題共20小題,1-10每題2分,11-20每題3分,共50分.每小題只有一個正確答案.
-
1.下列描述中,不正確的是( )
A.化學的特征就是認識分子和制造分子,它是一門具有創造性和實用性的科學 B.人們可以利用先進的技術和設備制造出新的原子和新的分子 C.制陶、冶金及釀酒過程中,肯定發生了化學變化 D.化學家可以在微觀層面上操縱分子和原子,組裝分子器件和分子機器等 組卷:145引用:5難度:0.9 -
2.設NA為阿伏加德羅常數的值。下列說法不正確的是( )
A.常溫常壓下,8 g O2含有0.5NA個原子 B.盛有SO2的密閉容器中含有NA個氧原子,則SO2的物質的量為0.5 mol C.常溫常壓下,22.4 L的NO2和CO2混合氣體含有2NA個O原子 D.常溫常壓下,14 g由N2與CO組成的混合氣體含有的原子數目為NA 組卷:18引用:1難度:0.7 -
3.常溫常壓下,用等質量的CH4、CO2、O2、SO2四種氣體分別吹出四個氣球,其中氣體為CH4的是( )
A. 
B. 
C. 
D.  組卷:194引用:29難度:0.7
組卷:194引用:29難度:0.7 -
4.下列溶液中Cl-濃度與50mL 1mol?L-1 AlCl3溶液中Cl-濃度相等的是( )
A.150 mL 1 mol?L-1的NaCl溶液 B.75 mL 2 mol?L-1 NH4Cl溶液 C.25 mL 1.5 mol?L-1的CuCl2溶液 D.75 mL 3 mol?L-1的KClO3溶液 組卷:15引用:2難度:0.9 -
5.下列各物質屬于電解質的是( )
①NaOH②BaSO4③Cu④蔗糖⑤CO2.A.①② B.①②⑤ C.③④ D.①③⑤ 組卷:17引用:2難度:0.9 -
6.下列關于物質分類的正確組合是( )
堿 酸 鹽 堿性氧化物 酸性氧化物 A Na2CO3 H2SO4 NaHCO3 NO2 CO2 B NaOH HCl NaCl Na2O CO C NaOH CH3COOH KNO3 SO3 SO2 D KOH HNO3 CaCO3 CaO SO3 A.A B.B C.C D.D 組卷:17引用:2難度:0.7 -
7.下列說法正確的是( )
A.直徑介于1nm~100nm之間的微粒稱為膠體 B.向飽和FeCl3溶液中滴加NaOH溶液可以得到Fe(OH)3膠體 C.利用丁達爾效應可以區分溶液和膠體 D.滲析是鑒別溶液和膠體的最簡便的方法 組卷:9引用:1難度:0.7 -
8.下列各化合物不能直接由單質間化合制取的是( )
A.FeCl2 B.CuCl2 C.AlCl3 D.FeCl3 組卷:198引用:9難度:0.9
二、非選擇題第II卷(50分)
-
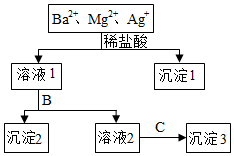 25.某溶液中只含有Ba2+、Mg2+、Ag+三種陽離子,現用適量的NaOH溶液、稀鹽酸和Na2SO4溶液將這三種離子逐一沉淀分離,其流程如圖所示:
25.某溶液中只含有Ba2+、Mg2+、Ag+三種陽離子,現用適量的NaOH溶液、稀鹽酸和Na2SO4溶液將這三種離子逐一沉淀分離,其流程如圖所示:
(1)生成沉淀1的離子方程式為。
(2)若試劑B為Na2SO4溶液,則沉淀2化學式為。
(3)若試劑B為NaOH溶液,則生成沉淀2的離子方程式為。
(4)如果原溶液中Ba2+、Mg2+、Ag+的濃度均為0.1mol?L-1,且溶液中含有的陰離子只有NO3-,則溶液中NO3-濃度為mol?L-1組卷:7引用:2難度:0.6 -
26.向50mLNa2SO4和Na2CO3的混合溶液中加入過量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中加入過量的稀HNO3,充分反應后,沉淀減少到4.66g,并有氣體產生.
(1)原混合溶液中Na2SO4和Na2CO3的物質的量濃度各是多少?
(2)產生的氣體在標準狀況下的體積是多少?組卷:81引用:12難度:0.3


