2021-2022學年河南省鄭州第四高級中學高二(下)第二次調研化學試卷
發(fā)布:2024/11/18 17:30:3
一、選擇題(共16小題,每小題3分,共48分。每小題只有一個選項符合題意。)
-
1.化學與生產生活息息相關,下列說法不正確的是( )
A.泡沫滅火器噴出的主要物質是Al(OH)3和CO2 B.長期使用(NH4)2SO4作化肥會使土壤酸化 C.電解飽和食鹽水可以得到金屬鈉和氯氣 D.合成氨工業(yè)中,將NH3及時液化分離有利于提高反應物的利用率 組卷:17引用:3難度:0.7 -
2.下列有關電解質電離過程的敘述不正確的是( )
A.NaCl溶于水破壞了離子鍵 B.HCl溶于水破壞了共價鍵 C.CH3COONa溶于水促進了水的電離 D.CH3COOH在水中的電離方程式為CH3COOH=H++CH3COO- 組卷:53引用:2難度:0.8 -
 3.下列說法正確的是( )
3.下列說法正確的是( )A.圖1為放熱反應,放熱反應不需要加熱就能反應 B.圖2為吸熱反應,分解反應均為吸熱反應 C.反應熱描述的是化學反應前后的熱量變化,任何化學反應都有反應熱 D.同溫同壓下,反應H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的ΔH不同 組卷:32引用:2難度:0.9 -
4.實驗測得:101kPa時,1molH2完全燃燒生成液態(tài)水,放出285.8kJ的熱量;1molCH4完全燃燒生成液態(tài)水和CO2,放出890.3 kJ的熱量。下列熱化學方程式書寫正確的是( )
A.2H2(g)+O2(g)═2H2O(l)ΔH=-571.6kJ?mol-1 B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=-890.3kJ C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔH=-890.3kJ?mol-1 D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=890.3kJ?mol-1 組卷:257引用:7難度:0.5 -
5.化學反應的方向問題對于理論研究與生產實踐都有及其重要的意義,下列有關化學反應方向的判斷不正確的是( )
A.ΔH<0,ΔS>0的反應在溫度低時不能自發(fā)進行 B.某吸熱反應能自發(fā)進行,因此該反應是熵增反應 C.Na與H2O的反應是熵增的放熱反應,該反應能自發(fā)進行 D.2NO(g)+2CO(g)═N2(g)+2CO2(g)在常溫下能自發(fā)進行,則該反應的ΔH<0 組卷:147引用:4難度:0.5 -
6.一定條件下,在密閉恒容的容器中,發(fā)生反應:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)△H<0,能表示該反應達到平衡狀態(tài)的是( )
A.v逆(N2)=v正(H2) B.v正(HCl)=4v正(SiCl4) C.混合氣體密度保持不變 D.c(N2):c(H2):c(HCl)=1:3:6 組卷:26引用:3難度:0.7 -
7.鐵的配合物離子(用[L-Fe-H]+表示)催化某反應的一種反應機理如圖所示,下列說法不正確的是( )

A.該過程的總反應為HCOOH CO2↑+H2↑催化劑B.增大HCOO-濃度有利于反應Ⅰ→Ⅱ速率加快 C.增大H+濃度有利于反應Ⅲ→Ⅳ速率加快 D.該催化循環(huán)中Fe元素的化合價發(fā)生了變化 組卷:12引用:4難度:0.6
二、填空題
-
20.四鉬酸銨是鉬深加工的重要中間產品,具有廣泛的用途。一種以鉬精礦(主要含MoS2,還有Cu、Fe的化合物及SiO2等)為原料制備四鉬酸銨的工藝流程如圖所示。
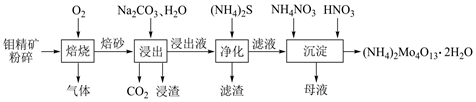
回答下列問題:
(1)四鉬酸銨(NH4)2Mo4O13中Mo的化合價為。
(2)“浸出”時,MoO3轉化為MoO42-的離子方程式為。
(3)“凈化”時,浸出液中殘留的Cu2+、Fe2+轉化為沉淀除去。若Cu2+、Fe2+殘留的濃度相等,則(填“Cu2+”或“Fe2+”)先生成沉淀。研究表明,該溶液中c(S2-)和pH的關系為:lgc(S2-)=pH-15.1。為了使溶液中的雜質離子濃度小于1.0×10-6mol?L-1,應控制溶液的pH不小于。(已知:pKsp=-lgKsp;CuS和FeS的pKsp分別為35.2和17.2)
(4)“凈化”后,溶液中的低價鉬(以MoO32-表示)可加入適量H2O2將其氧化為MoO42-,該反應的離子方程式為。
(5)“沉淀”時,加入HNO3的目的是。組卷:52引用:1難度:0.6 -
21.我國力爭于2030年前做到碳達峰,2060年前實現(xiàn)碳中和。研發(fā)二氧化碳利用技術,降低空氣中二氧化碳含量成為研究熱點。
(1)雨水中含有來自大氣的CO2,CO2進一步和水反應發(fā)生電離:
ⅰCO2(g)?CO2(aq)
ⅱCO2(aq)+H2O(l)?H+(aq)+(aq)HCO-3
①增大CO2在水中溶解度的措施有(寫出一條即可)。
②25℃時,c(H+)c()+c(OH-)(填“>”、“<”或“=”)。HCO-3
(2)CH4與CO2重整是有利于實現(xiàn)碳達峰和碳中和的研究熱點之一。該重整反應體系主要涉及以下反應:
a、CH4(g)+CO2(g)?2CO(g)+2H2(g)
b、CH4(g)?C(s)+2H2(g)
c、CO(g)+H2(g)?H2O(g)+C(s)
設為相對壓力平衡常數(shù),其表達式寫法:在濃度平衡常數(shù)表達式中,用相對分壓代替濃度。氣體的相對分壓等于其分壓除以p0(p0=100kPa)。反應a、b、c的Krp(lnKrp為以e為底的對數(shù))隨T(溫度)的變化如圖所示。lnKrp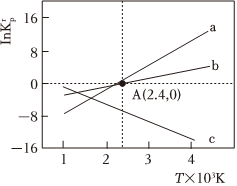
①反應a、b、c中,屬于放熱反應的有(填字母)。
②反應b的相對壓力平衡常數(shù)表達式為=Krp。
③在圖中A點對應溫度下,原料組成為n(CO2):n(CH4)=1:1,初始總壓為100kPa的恒容密閉容器中進行反應,體系達到平衡時CH4的平衡轉化率為68%,則H2的分壓為kPa。組卷:82引用:1難度:0.5


