2022-2023學年江蘇省鹽城市高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:共13題,每題3分,共39分。每題只有一個選項最符合題意。
-
1.我國下列科技成果或其應用中涉及氧化還原反應的是( )
A.引爆黑火藥開采礦石 B.用乙醚提取青蒿素 C.用天然磁石造出司南 D.用侯氏制堿法制取純堿 組卷:10引用:2難度:0.7 -
2.利用反應CO2+H2O+NH3═NH4HCO3可制備碳銨。下列說法正確的是( )
A.NH3中N元素的化合價為-3 B.H2O的空間構型為直線形 C.CO2的電子式為: 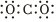
D.NH4HCO3僅含共價鍵 組卷:42引用:2難度:0.8 -
3.向NaAlO2溶液中滴加適量NaHCO3溶液可生成Al(OH)3沉淀。下列說法正確的是( )
A.半徑大小:r(O2-)<r(Al3+) B.電負性大小:χ(H)>χ(Na) C.堿性強弱:NaOH<Al(OH)3 D.電離能大小:I1(C)>I1(O) 組卷:31引用:2難度:0.7 -
4.實驗室制取少量的氯水并探究其性質,下列實驗裝置和操作能達到實驗目的的是( )

A.用裝置甲制取氯氣 B.用裝置乙制取氯水 C.用裝置丙處理尾氣 D.用pH試紙測氯水的pH 組卷:14引用:2難度:0.7
二、非選擇題:共4題,共61分。
-
16.鐵黃(FeOOH)是重要的化工產品。某學校興趣小組用如圖所示裝置,進行鐵黃制備研究,具體操作如下:向三頸燒瓶中依次加入250mL3.0mol?L-1硫酸亞鐵溶液、鐵黃晶種和過量碎鐵皮,在80℃水浴加熱條件下,持續通入空氣并不斷攪拌,在晶種上得到鐵黃晶體。

(1)檢驗反應完成后上層溶液中是否存在Fe3+的實驗方法為。
(2)結合反應原理解釋加入過量碎鐵皮的作用是。
(3)測定樣品中鐵黃的質量分數。
①配制100mL0.500mol?L-1K2Cr2O7標準溶液。實驗過程可描述為,繼續加入蒸餾水至離刻度線1~2cm處,改用膠頭滴管加水至溶液凹液面最低處與刻度線相切,塞好瓶塞,顛倒搖勻,裝瓶貼上標簽。
②稱取鐵黃樣品6.000g置于250mL錐形瓶中,加入適量稀鹽酸、加熱,滴加稍過量的SnCl2溶液(將Fe3+還原為Fe2+)充分反應,再除去過量的Sn2+。用上述配制的K2Cr2O7標準溶液滴定至終點(Cr2+14H++6Fe2+═6Fe3++2Cr3++7H2O),消耗K2Cr2O7溶液22.00mL。計算該樣品中鐵黃的質量分數O2-7(寫出計算過程)。
(4)鐵和氨在640℃時可發生置換反應,一種產物的晶胞結構如圖所示。
①該產物的化學式為。
②氮原子位于由鐵原子構成的正八面體的中心。在答題卡的中用“-”將鐵原子構成的正八面體連接起來。組卷:12引用:2難度:0.5 -
17.廢水中過高的氨氮(以NH3、
形式存在)含量,可通過化學沉淀、電解或微生物催化等方法處理后達到國家規定的排放標準。NH+4
(1)化學沉淀法:控制溶液pH=10,向含氨氮(以為例)的廢水中以一定比例投加MgCl2?6H2O和Na2HPO4?12H2O,生成難溶于水的磷酸銨鎂(MgNH4PO4)沉淀。NH+4
①該法需先投加的試劑是。
②溶液pH過高,氨氮去除率會下降。其原因是。
(2)電解法:電解NaCl溶液,用電極附近產生NaClO、HClO將氨氮氧化去除。廢水中的氮剩余量隨ρ(Cl-)的變化如圖所示,當ρ(Cl-)>8000mg?L-1時,氮剩余量隨ρ(Cl-)增大而增多的可能原因是。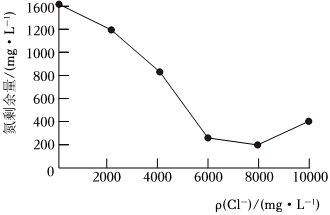
(3)生物硝化反硝化法。
①如圖所示,通過硝化和反硝化細菌將廢水中的氨氮轉化為氮氣去除。
ⅰ)反應過程中需控制廢水的pH在8~8.2,溫度保持15℃。控制該條件的原因是。
ⅱ)反硝化過程:硝化產生的和NO-2和水體有機物(以CH3OH為例)在反硝化細菌作用下生成氮氣和碳酸鹽,溶液的pH上升。寫出NO-3和CH3OH反應的離子方程式:NO-2。
②科學家發現某些生物酶體系可以促進H+和e-的轉移(如途徑a、b和c),能將海洋中的轉化為N2進入大氣層,反應過程如圖所示。從電子、電荷守恒的角度描述NH+4轉化為N2過程為NH+4。 組卷:38引用:2難度:0.5
組卷:38引用:2難度:0.5


