2021年四川省南充市閬中中學高考化學質檢試卷(4月份)
發布:2025/1/3 3:0:2
一、選擇題(共7小題,每小題0分,滿分0分)
-
1.化學與生活密切相關。下列物質性質與應用的對應關系錯誤的是( )
A.硅膠吸水能力強,可用作食品、藥品的干燥劑 B.氫氧化鋁堿性不強,可用作胃酸中和劑 C.次氯酸鈉具有強氧化性,可用作織物的漂白劑 D.葡萄糖具有強氧化性,可用于醫用營養液 組卷:31引用:2難度:0.9 -
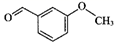 2.茴香醛可用于香料的配制和有機合成,其中間茴香醛的結構簡式如圖所示。下列關于茴香醛的說法正確的是( )
2.茴香醛可用于香料的配制和有機合成,其中間茴香醛的結構簡式如圖所示。下列關于茴香醛的說法正確的是( )A.其分子式是C8H10O B.不能與氫氣反應 C.分子中所有碳原子可能共平面 D.對茴香醛中含有3種不同化學環境的氫原子 組卷:33引用:1難度:0.7 -
3.設NA為阿伏加德羅常數的值。下列有關敘述正確的是( )
A.5.6 L甲烷含有的共價鍵數為NA B.2 g D216O和2 g H218O中含有的中子數均為NA C.過氧化鈉與水反應時,生成0.1 mol氧氣轉移的電子數為0.4NA D.常溫下pH=13的Ba(OH)2溶液中含有的OH-離子數為0.1NA 組卷:254引用:3難度:0.2
二、解答題(共4小題,滿分0分)
-
 10.羰基硫(COS)廣泛存在于以煤、石油和天然氣為原料的化工生產中,不經處理直接排放會引起大氣污染,石油化工中產生的羰基硫可通過以下方法脫除。
10.羰基硫(COS)廣泛存在于以煤、石油和天然氣為原料的化工生產中,不經處理直接排放會引起大氣污染,石油化工中產生的羰基硫可通過以下方法脫除。
Ⅰ.干法脫除:在催化劑存在下,COS和H2可發生兩個平行反應:
ⅰ.COS(g)+H2(g)?H2S(g)+CO(g)△H1=-17kJ/mol
ⅱ.COS(g)+4H2(g)?H2S(g)+CH4(g)+H2O(g)△H2
(1)已知:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ/mol,則△H2=,羰基硫的結構與二氧化碳相似,電子式為
(2)在密閉體系中,投入一定量COS(g)和H2(g)只發生反應i,平衡后保持溫度和壓強不變通入適量的He,則正反應速率,COS的轉化率。(填“增大”、“減小”或“不變”)
(3)T1℃時,向10L恒容密閉容器中充入1mol COS和4mol H2,發生反應i和ii。5min時達到平衡,測得體系壓強減少了20%,CO的體積分數為10%。
①0~5min內,v(COS)=。
②反應i的平衡常數K=。
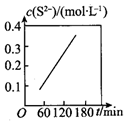
Ⅱ.濕法脫除:原理為COS+4OH-═S2-+CO32-+2H2O。溫度為293K時,將COS以固定流速勻速通入定濃度的NaOH溶液中,測得體系內c(S2-)隨時間(t)的變化如圖所示。
(4)由圖可知,增大NaOH溶液的初始濃度,COS的吸收速率(填“增大”、“減小”或“不變”),判斷依據為。組卷:17引用:1難度:0.3 -
11.硫、釩化合物在藥物化學及催化化學等領域應用廣泛。回答下列問題:
(1)基態釩原子的電子排布式為,核外電子有種空間運動狀態釩有+2、+3、+4、+5等多種化合價,其中最穩定的化合價是,VO43-的空間構型為。
(2)2-巰基煙酸氧釩配合物(圖甲)是副作用小的有效調節血糖的新型藥物:該藥物中N原子的雜化方式是;2-巰基煙酸(圖乙)水溶性優于2-巰基煙酸氧釩配合物(圖乙)的原因是。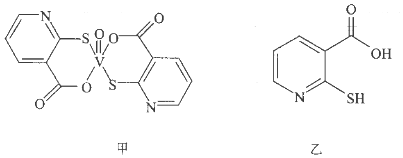
(3)某六方硫釩化合物晶體的晶胞如圖丙所示,該晶胞的化學式為。圖丁為該晶胞的俯視圖,該晶胞的密度為g/cm3(列出計算式即可)。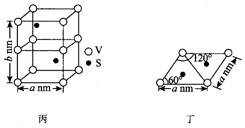 組卷:20引用:1難度:0.6
組卷:20引用:1難度:0.6


