2020-2021學年云南省大理州大理市下關一中高一(下)月考化學試卷(3月份)
發布:2024/12/3 0:0:2
一、選擇題(本題共25小題,共50分。每題只有一項符合題意)
-
1.下列諺語或古籍記載都與化學現象有關,說法不正確的是( )
A.“鹵水點豆腐,一物降一物”與膠體性質有關 B.“用過天晴云破處”所描述的瓷器青色,來自氧化鐵 C.《呂氏春秋?別類編》中“金(即銅)柔錫柔,合兩柔則剛”體現了合金硬度方面特性 D.《肘后備急方》中“青蒿一握,以水二升漬,絞取汁,盡服之”該過程屬于物理變化 組卷:28引用:2難度:0.8 -
2.下列關于物質的分類中,正確的是( )
選項 酸性氧化物 酸 堿 鹽 混合物 電解質 A SiO2 HClO 純堿 明礬 CuSO4?5H2O CO2 B Na2O2 HNO3 生石灰 NaHSO4 鹽酸 Mg C SO3 H2SiO3 燒堿 碳酸氫鈉 澄清石灰水 NaCl D NO Al(OH)3 熟石灰 BaCO3 液氯 NH3 A.A B.B C.C D.D 組卷:36引用:4難度:0.7 -
3.下列有關敘述中錯誤的是( )
A.S2-的結構示意圖: 
B.原子核內有18個中子的氯原子: Cl3517C.Na2O2中氧元素的化合價為-1 D.元素周期表中鉍元素的數據如圖  ,其中209.0指的是Bi元素的質量數組卷:53引用:5難度:0.6
,其中209.0指的是Bi元素的質量數組卷:53引用:5難度:0.6 -
4.化學在日常生活中有著廣泛的應用,下列對應關系不正確的是( )
實際應用 化學性質 A 鋁箔在酒精燈火焰上加熱熔化但不滴落 鋁箔表面氧化鋁的熔點高于鋁 B FeCl3腐蝕Cu刻制印刷電路板 鐵比銅還原性強 C Al(OH)3可用于制胃酸中和劑 Al(OH)3具有弱堿性 D 明礬、硫酸鐵可作凈水劑 溶于水形成膠體從而凝聚水中的懸浮物 A.A B.B C.C D.D 組卷:0引用:1難度:0.7 -
5.用下列裝置不能達到有關實驗目的的是( )

A.用甲圖裝置證明ρ(煤油)<ρ(鈉)<ρ(水) B.用乙圖裝置制備Fe(OH)2 C.用丙圖裝置驗證非金屬性:Cl>C>Si D.用丁圖裝置比較NaHCO3和Na2CO3的熱穩定性 組卷:3引用:1難度:0.5 -
6.用NA表示阿伏加德羅常數的值,下列敘述正確的是( )
A.標準狀況下,22.4LH2O含有的分子數為NA B.Na2O2與CO2反應生成0.1molO2時轉移電子0.2NA C.常溫常壓下,7.8g Na2O2固體中含有的陰離子數為0.2 NA D.高溫下,0.2 molFe與足量水蒸氣反應,生成的H2分子數目為0.3NA 組卷:13引用:2難度:0.8 -
7.電視劇中《三生三世十里桃花》中的仙境美輪美奐,其中所需的煙霧是在放于溫熱石棉網上的NH4NO3和Zn粉的混合物中滴幾滴水后產生的白煙:NH4NO3+Zn═ZnO+N2↑+2H2O,下列說法中正確的是( )
A.被1mol Zn氧化的氮原子為0.4mol B.常溫下每消耗1.3g Zn粉,即可產生448mL N2 C.氮氣既是氧化產物也是還原產物 D.每生成1mol ZnO共轉移2mol電子 組卷:79引用:2難度:0.4 -
8.能正確表示下列反應的離子反應方程式為( )
A.用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ B.向明礬溶液中逐滴加入Ba(OH)2溶液至SO42-完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ C.Na2O2溶于水:Na2O2+H2O=2Na++2OH-+O2↑ D.向Al2(SO4)3溶液中加入過量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ 組卷:6引用:1難度:0.7 -
9.某溶液中有Fe3+、Fe2+、Mg2+和Al3+四種離子,若向其中加入過量的Na2O2并攪拌,再加入過量鹽酸,溶液中大量減少的陽離子是( )
A.Mg2+ B.Fe3+ C.Fe2+ D.Al3+ 組卷:14引用:2難度:0.6
二、解答題(共4小題,滿分50分)
-
28.已知:A為淡黃色固體,T、R為兩種常見的用途很廣的金屬單質,D是具有磁性的黑色晶體,H是白色沉淀,W溶液中加入KSCN溶液出現紅色。各物質之間的轉化關系如圖所示,請回答下列問題:

(1)寫出化學式:D,W。
(2)H在潮濕空氣中變成M的化學方程式。
(3)寫出Q+B→N的離子方程式;在C與R反應中,當有20.4gQ物質生成時,轉移電子mol。
(4)D→E過程中②的離子方程式。
(5)將一定量T2O3和R2O3混合物溶于100mL稀硫酸中,向反應后的溶液中緩慢加入NaOH溶液,加入NaOH溶液的體積與生成沉淀的質量關系如圖所示,試回答:
①混合物中含T2O3的質量為g;
②所用硫酸溶液物質的量濃度為mol?L-1。組卷:4引用:1難度:0.4 -
29.實驗小組制備高鐵酸鉀(K2FeO4)并探究其性質。
資料:K2FeO4為紫色固體,微溶于KOH溶液;具有強氧化性,在酸性或中性溶液中快速產生O2,在堿性溶液中較穩定。
Ⅰ、制備K2FeO4(夾持裝置略)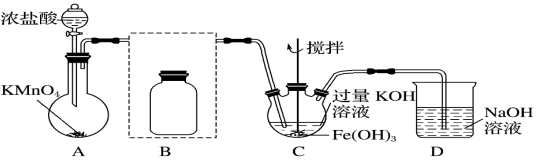
(1)寫出A中產生氯氣的離子方程式:
(2)將除雜裝置B補充完整并標明所用試劑:
(3)在C中反應的離子方程式:
Ⅱ、探究K2FeO4的性質:取C中紫色溶液,加入稀硫酸,產生氣體和溶液a。為證明是否K2FeO4氧化了Cl-而產生Cl2,設計以下方案:
(4)由方案Ⅰ中溶液變紅可知a中含有方案Ⅰ 取少量a,滴加KSCN溶液至過量,溶液呈紅色 方案Ⅱ 用KOH溶液充分洗滌C中所得固體,再用KOH溶液將K2FeO4溶解,得到紫色溶液b,取少量b,滴加鹽酸,有Cl2產生 離子,根據方案Ⅱ得出:氧化性Cl2FeO42-(填“>”或“<”)。
(5)使用時經常通過測定高鐵酸鉀的純度來判斷其是否變質。K2FeO4在硫酸溶液中反應如下:FeO42-+H+=O2↑+Fe3++。
①完成并配平上述離子方程式。
②現取C中洗滌并干燥后樣品的質量10g,加入稀硫酸,收集到0.672L氣體(標準狀況)。則樣品中高鐵酸鉀的質量分數為。(計算結果保留到0.1%)組卷:8引用:2難度:0.5


