2020-2021學年河北省張家口一中普實班高二(上)月考化學試卷(10月份)
發布:2024/4/20 14:35:0
一、選擇題(每題只有一個正確選項)
-
1.下列說法正確的是( )
A.SO3的水溶液能導電,所以SO3是電解質 B.自由移動離子數目多的電解質溶液導電能力一定強 C.NaHSO4在水溶液里及熔融狀態下均可電離出Na+、H+、SO42- D.NH3屬于非電解質,但其水溶液能夠導電 組卷:254引用:11難度:0.9 -
2.下列防止進入腐蝕的做法中,不可行的是( )
A.軍事演習期間給坦克的履帶上刷上油漆以防止生銹 B.地下鋼管道每隔一段距離就連結一定數量鎂塊 C.在輪船外殼水線以下部分裝上一定數量的鋅塊 D.洗衣機的滾筒采用不銹鋼材料,即耐磨又耐腐蝕 組卷:17引用:4難度:0.5 -
3.在水中加入下列物質,能促進水的電離的是( )
A.H2SO4 B.KOH C.FeCl3 D.Ba (NO3)2 組卷:10引用:2難度:0.9 -
4.在0.1mol?L-1 CH3COOH溶液中存在如下電離平衡:CH3COOH?CH3COO-+H+,對于該平衡,下列敘述正確的是( )
A.加入水時,平衡向逆反應方向移動 B.加入少量NaOH固體,平衡向正反應方向移動 C.加入少量0.1mol?L-1 HCl溶液,溶液中c(H+)減小 D.加入少量CH3COONa固體,平衡向正反應方向移動 組卷:749引用:83難度:0.9 -
5.下列物質中,既有離子鍵,又有共價鍵的是( )
A.KOH B.CaCl2 C.H2O D.NaCl 組卷:39引用:7難度:0.9 -
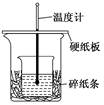 6.某實驗小組學生用50mL 0.50 mol/L的鹽酸與50 mL 0.55 mol/L的NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量計算反應熱。下列說法不正確的是( )
6.某實驗小組學生用50mL 0.50 mol/L的鹽酸與50 mL 0.55 mol/L的NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量計算反應熱。下列說法不正確的是( )A.若改用60 mL 0.50 mol/L鹽酸跟50 mL 0.55 mol/L的NaOH溶液進行反應,從理論上說所求反應熱不變 B.圖中實驗裝置缺少環形玻璃攪拌棒 C.燒杯間填滿碎紙條的作用是防止熱量損失,減少實驗誤差 D.如圖條件下實驗過程中沒有熱量損失 組卷:45引用:5難度:0.7 -
7.在相同溫度時100mL 0.01mol/L的醋酸溶液與10mL 0.1mol/L的醋酸溶液相比較,下列數值前者大于后者的是( )
A.中和時所需NaOH的量 B.電離程度 C.H+的物質的量的量濃度 D.CH3COOH的物質的量 組卷:84引用:6難度:0.5
二、簡答題。
-
 22.25℃時,電離平衡常數:
22.25℃時,電離平衡常數:
回答下列問題:化學式 CH3COOH H2CO3 HClO 電離平衡常數 1.8×10-5 K14.3×10-7
K25.6×10-113.0×10-8
(1)下列四種離子結合質子的能力由大到小的順序是;(填編號)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反應不能發生的是
a.CO32-+CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸餾水稀釋0.10mol?L-1的醋酸,則下列各式表示的數值隨水量的增加而增大的是
A.c(CH3COOH)c(H+)
B.c(CH3COO-)c(CH3COOH)
C.c(H+)Kw
D.c(H+)c(OH-)
(4)體積為10mL pH=2的醋酸溶液與一元酸HX分別加水稀釋至1 000mL,稀釋過程pH變化如圖,則HX的電離平衡常數(填“大于”、“等于”或“小于”)醋酸的平衡常數,稀釋后,HX溶液中水電離出來的c(H+)醋酸溶液中水電離出來的c(H+)(填“大于”、“等于”或“小于”)組卷:63引用:7難度:0.5 -
23.如圖1所示,某同學設計一個燃料電池并探究氯堿工業原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。

根據要求回答相關問題:
(1)通入氧氣的電極為(填“正極”或“負極”),負極的電極反應式為。
(2)鐵電極為(填“陽極”或“陰極”),石墨電極(C)的電極反應式為。
(3)如果粗銅中含有鋅、銀等雜質,丙裝置中反應一段時間,硫酸銅溶液濃度將(填“增大”“減小”或“不變”)。
(4)若在標準狀況下,有2.24L氧氣參加反應,則乙裝置中鐵電極上生成的氣體的分子數為;丙裝置中陰極析出銅的質量為。
(5)利用如圖2制作一種環保型消毒液發生器,電解可制備“84”消毒液的有效成分,則c為電源的極;該發生器中反應的總離子方程式為。
(6)氯堿工業是高耗能產業,一種將電解池與燃料電池相組合的新工藝可以節(電)能30%以上。該工藝的相關物質運輸與轉化關系如圖3所示(其中的電極未標出,所用的離子膜都只允許陽離子通過)。
分析圖可知,氫氧化鈉的質量分數為a%、b%、c%,由大到小的順序為。組卷:57引用:2難度:0.5


