人教版(2019)選擇性必修1《1.2 反應熱的計算》2023年同步練習卷(1)(1)
發布:2024/8/16 21:0:1
一、選擇題
-
1.通過化學反應完成物質的轉化,可用于治理污染、保護環境,實現可持續發展。已知:
①S(g)+2H2O(g)═2H2(g)+SO2(g)△H=-90.4kJ/mol
②2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ/mol
則反應CO(g)+H2O(g)═CO2(g)+H2(g)△H=( ) kJ/molA.-82.4 B.-90.4 C.-41.2 D.+8.0 組卷:38引用:2難度:0.9 -
2.已知:CH4 在一定條件下可發生一系列反應,如圖所示:下列說法不正確的是( )

A.ΔH1>ΔH5 B.ΔH3=ΔH2-ΔH5 C.ΔH1=ΔH2+ΔH3+ΔH4 D.ΔH4>0 組卷:173引用:6難度:0.8 -
3.由氫氣和氧氣反應生成4.5g水蒸氣放出熱60.45kJ,則反應:2H2(g)+O2(g)
2H2O(g)的△H為( )點燃A.-483.6kJ?mol-1 B.-241.8kJ?mol-1 C.-120.6kJ?mol-1 D.+241.86kJ?mol-1 組卷:39引用:8難度:0.9 -
4.已知:2CO(g)+O2(g)═2CO2(g)ΔH=-566kJ?mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+O2(g)ΔH=-226kJ?mol-112
根據以上熱化學方程式判斷,下列說法正確的是( )A.CO的燃燒熱為283 kJ B.圖可表示由CO生成CO2的反應過程和能量關系 
C.2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)ΔH=-452 kJ?mol-1 D.CO(g)與Na2O2(s)反應放出509 kJ熱量時,電子轉移數為1.204×1024 組卷:23引用:5難度:0.7 -
 5.已知化學反應的熱效應只與反應物的初始狀態和生成物的最終狀態有關,如圖(Ⅰ)所示:△H1=△H2+△H3,根據上述原理和圖(Ⅱ)所示,判斷各對應的反應熱關系中不正確的是( )
5.已知化學反應的熱效應只與反應物的初始狀態和生成物的最終狀態有關,如圖(Ⅰ)所示:△H1=△H2+△H3,根據上述原理和圖(Ⅱ)所示,判斷各對應的反應熱關系中不正確的是( )A.A→F△H=-△H6 B.A→D△H=△H1+△H2+△H3 C.△H1+△H2+△H3+△H4+△H5+△H6=0 D.△H1+△H6=△H2+△H3+△H4+△H5 組卷:231引用:14難度:0.9 -
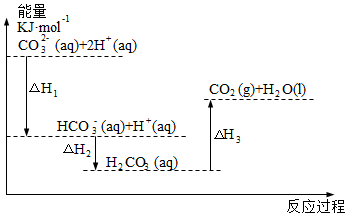 6.向Na2CO3溶液中滴加鹽酸,反應過程中能量變化如圖所示,下列說法正確的是( )
6.向Na2CO3溶液中滴加鹽酸,反應過程中能量變化如圖所示,下列說法正確的是( )A.HCO3-(aq)+H+(aq)═CO2(g)+H2O(l) 為放熱反應 B.CO32-(aq)+2H+(aq)═CO2(g)+H2O(l)△H=△H1+△H2+△H3 C.△H1>△H2 D.△H2>△H3 組卷:8引用:2難度:0.7 -
7.Mn2+催化H2O2分解:2H2O2(aq)═2H2O(l)+O2(g)△H1,其反應機理如下:

若反應Ⅱ的焓變為△H2,反應Ⅰ、Ⅱ的化學計量數均為最簡整數比,則反應Ⅰ的焓變△H為( )A.△H1+△H2 B.△H1-△H2 C.2△H1-△H2 D.△H1-2△H2 組卷:233引用:11難度:0.5 -
8.已知A(g)+C(g)=D(g);△H=-Q1kJ/mol,B(g)+C(g)=E(g),△H=-Q2kJ/mol,Q1、Q2均大于0,且Q1>Q2,若A與B組成的混合氣體1mol與足量的C反應,放熱為Q3kJ,則原混合氣體中A與B物質的量之比為( )
A. Q3-Q2Q1-Q3B. Q1-Q3Q3-Q2C. Q3-Q2Q1-Q2D. Q1-Q3Q1-Q2組卷:114引用:11難度:0.7
三、多選題
-
23.下列各組反應中的ΔH大小比較正確的是( )
熱化學方程式 ΔH大小比較 A S(g)+O2(g)=SO2(g)ΔH1 ΔH1<ΔH2 S(s)+O2(g)=SO2(g)ΔH2 B 2H2(g)+O2(g)=2H2O(l)ΔH1 ΔH1>ΔH2 2H2(g)+O2(g)=2H2O(g)ΔH2 C CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)ΔH1 ΔH1<ΔH2 HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)ΔH2 D 2Na(s)+O2(g)=Na2O2(s)ΔH1 ΔH1>ΔH2 4Na(s)+O2(g)=2Na2O(s)ΔH2 A.A B.B C.C D.D 組卷:25引用:2難度:0.7
四、解答題
-
24.甲醇既是重要的化工原料,又可作為燃料。利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,發生的主要反應如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列問題:
(1)已知反應①中的相關的化學鍵鍵能數據如下:
由此計算△H1=化學鍵 H-H C-O C≡O H-O C-H E/( kJ?mol-1) 436 343 1076 465 413 。已知△H2=-58kJ?mol-1,則△H3=。
(2)合成氣中的氫氣是發展中的新能源,它的利用包括制備、儲存和應用三個環節。與汽油相比,氫氣作為燃料的優點是(寫出兩點),缺點是(寫出兩點)。組卷:9引用:2難度:0.5


