2021-2022學年湖南省長沙市長郡中學高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括10小題,每小題3分,共30分.在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.化學與生產、生活密切相關,生活中處處有化學,化學讓世界更美好。下列敘述正確的是( )
A.“84”消毒液等含氯消毒劑、過氧乙酸、體積分數為75%的酒精等均可以有效滅活新型冠狀病毒,所以將“84”消毒液與75%酒精1:1混合,消毒效果更好 B.鋼鐵制品和純銅制品均既能發生吸氧腐蝕又能發生析氫腐蝕 C.CO、SO2、NO、NO2均為大氣污染物,“燃煤固硫”、“汽車尾氣催化凈化”能提高空氣質量 D.“嫦娥五號”使用的太陽能電池陣和鋰離子電池組,均可將化學能轉變成電能 組卷:32引用:4難度:0.6 -
2.下列說法正確的是(ΔH的絕對值均正確)( )
A.熱值指在一定條件下單位質量的物質完全燃燒所放出的熱量,則CO熱值為10.1kJ/g B.已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ/mol,則稀醋酸與稀氫氧化鈉溶液反應生成1mol水的中和熱為-57.3kJ/mol C.C2H5OH的燃燒熱C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)ΔH=-1367.0kJ/mol D.已知C(石墨,s)═C(金剛石,s)ΔH>0,則1molC(金剛石,s)的總鍵能比1molC(石墨,s)的總鍵能大 組卷:22引用:1難度:0.5 -
3.亞磷酸(H3PO3)是一種二元弱酸,常溫下電離常數Ka1=1.0×10-3,Ka2=2.6×10-7,下列說法正確的是( )
A.H3PO3與足量的NaOH溶液反應生成Na3PO3 B.對亞磷酸溶液升溫,溶液的pH變大 C.向亞磷酸溶液中加入少量NaOH固體,則 變大c(H2PO3-)c(H3PO3)D.對0.01mol/L的亞磷酸溶液加水稀釋,溶液中各離子濃度均減小 組卷:34引用:2難度:0.6 -
4.燃料電池是燃料(如CO、H2、CH4、C2H6等)跟氧氣(或空氣)起反應將化學能轉變為電能的裝置,若電解質溶液是強堿溶液,下面關于乙烷(C2H6)燃料電池的說法正確的是( )
A.該電池工作時,正極附近溶液的堿性增強 B.負極反應式:C2H6+18OH-+14e-=2CO32-+12H2O C.通入5.6LO2完全反應后,有1mol電子發生轉移 D.燃料電池的優點之一是點燃時化學能大部分轉化為電能而不是熱能和光能 組卷:39引用:2難度:0.5 -
5.下列說法或有關化學用語的使用正確的是( )
A.在基態多電子原子中,p軌道電子的能量一定高于s軌道電子的能量 B.基態Fe原子的價層軌道表示式為 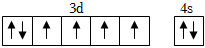
C.硫的電負性比磷大,故硫元素的第一電離能比磷元素的第一電離能大 D.基態銅原子的價層電子排布式為3d94s2 組卷:62引用:2難度:0.6 -
6.下列實驗事實和對實驗事實的理論解釋都正確的是( )
選項 實驗事實 理論解釋 A H2S的沸點比H2O的高 H2S的范德華力大于H2O的范德華力 B 白磷為正四面體分子 白磷分子中P-P-P的鍵角是109.5° C 1體積水可以溶解700體積氨氣 氨是極性分子且有氫鍵的影響 D 鍵的極性:H-O>N-H 非金屬性差異越大,鍵的極性越小 A.A B.B C.C D.D 組卷:194引用:5難度:0.7
三、非選擇題(本題包括4小題,共54分)
-
17.硫及其化合物在生產生活中有廣泛的應用.請回答:
(1)室溫下,Na2SO3溶液呈堿性的原因是(用離子方程式表示)。
(2)下列關于硫及其化合物的說法,正確的是(填標號)。
A.硫元素在自然界中只能以化合態形式存在
B.SO2通入紫色石蕊試液,先變紅后褪色
C.酸雨是pH<7的降水,主要是由污染物SO2、NO2造成
D.濃硫酸中加入少量膽礬晶體,攪拌,固體逐漸變成白色
(3)光譜研究表明,SO2的水溶液中存在如圖平衡:
其中K1、K2、K3為各步的平衡常數,且K1=[p(SO2)表示SO2的平衡壓強]。c(SO2?xH2O)p(SO2)
①當SO2的平衡壓強為p時,測得c(SO32-)=amol?L-1,則溶液c(H+)=mol?L-1(用含p、a、K1、K2、K3的式子表示)。
②滴加NaOH溶液至pH=6.2時,溶液中=n(SO32-)n(HSO3-)。如果溶液中991=n(SO32-)n(HSO3-),需加NaOH溶液將pH調整為約等于919。
(4)氨水也可吸收SO2:2NH3+SO2+H2O═(NH4)2SO3,(NH4)2SO3+SO2+H2O═2NH4HSO3。能提高SO2去除率的措施有(填標號)。
A.增大氨水濃度
B.加熱煮沸
C.降低煙氣的流速
D.補充O2,將HSO3-氧化為SO42-組卷:17引用:1難度:0.6 -
18.非金屬氟化物在生產、生活和科研中應用廣泛。回答下列問題:
(1)基態F原子核外電子的運動狀態有種。
(2)O、F、Cl電負性由大到小的順序為;OF2分子的空間結構為;OF2的熔、沸點(填“高于”或“低于”)Cl2O,原因是。
(3)Xe是第五周期的稀有氣體元素,與F形成的XeF2室溫下易升華。XeF2中心原子的價層電子對數為,下列對XeF2中心原子雜化方式推斷合理的是(填標號)。
A.sp
B.sp2
C.sp3
D.sp3d組卷:40引用:2難度:0.6


