2022-2023學(xué)年北京市平谷區(qū)高二(上)期末化學(xué)試卷
發(fā)布:2024/10/28 17:30:3
一、本部分共14小題,每小題3分,共42分。在每小題列出的四個(gè)選項(xiàng)中,只有一項(xiàng)是最符合題目要求的,請將正確選項(xiàng)填涂在答題卡上。
-
1.下列物質(zhì)不屬于弱電解質(zhì)的是( )
A.CH3COOH B.NH3?H2O C.H2CO3 D.Ca(ClO)2 組卷:16引用:1難度:0.6 -
2.下列溶液因水解而呈酸性的是( )
A.NaHSO4溶液 B.NH4Cl溶液 C.NaHCO3溶液 D.H2SO3溶液 組卷:36引用:1難度:0.7 -
3.“中和反應(yīng)反應(yīng)熱的測定”實(shí)驗(yàn)中,不需要使用的儀器是( )
A.容量瓶 B.溫度計(jì) C.玻璃攪拌器 D.量筒 組卷:66引用:3難度:0.8 -
4.用鉑電極電解含有下列溶質(zhì)的溶液,電解時(shí)陰極和陽極上同時(shí)都有氣體產(chǎn)生,且溶液的pH增大的是( )
A.H2SO4 B.CuSO4 C.HCl D.KNO3 組卷:65引用:1難度:0.8 -
5.下列說法不正確的是( )
A.周期表中ⅠA族元素的價(jià)電子排布式ns1 B.在電子云圖中,用小黑點(diǎn)表示繞核做高速圓周運(yùn)動(dòng)的電子 C.同種原子的原子軌道能量:1s<2s<3s D.F、O、N三種元素的電負(fù)性依次減小 組卷:61引用:1難度:0.8 -
6.水凝結(jié)成冰的過程中,下列分析不正確的是( )
A.該過程屬于物理變化 B.H2O(l)=H2O(s)ΔH>0 C.等質(zhì)量水和冰所具有的內(nèi)能不同 D.該過程是熵減的過程 組卷:3引用:1難度:0.8
二、解答題(共6小題,滿分0分)
-
19.實(shí)現(xiàn)二氧化碳選擇性、穩(wěn)定性加氫合成甲醇是“甲醇經(jīng)濟(jì)”理念下的一個(gè)重要成果。
反應(yīng)包括兩步:
Ⅰ.CO2(g)+H2(g)?CO(g)+H2O(g)△H1=+40.9kJ/mol
Ⅱ.CO(g)+2H2(g)?CH3OH(g)△H2=-90.4kJ/mol
(1)由CO2合成CH3OH(g)的熱化學(xué)方程式
(2)恒壓下,按n(CO2):n(H2)=1:3時(shí),該反應(yīng)在無分子篩膜和有分子篩膜時(shí)甲醇的平衡產(chǎn)率隨溫度的變化如圖所示。(分子篩膜能選擇性分離出H2O)。
①根據(jù)圖中數(shù)據(jù),壓強(qiáng)不變時(shí)采用有分子篩膜時(shí)的最佳反應(yīng)溫度為℃
②有分子篩膜時(shí)甲醇產(chǎn)率高的原因是。
(3)如果在不同壓強(qiáng)下,CO2和H2的起始物質(zhì)的量比仍為1:3,測定CO2的平衡轉(zhuǎn)化率和CH3OH的平衡產(chǎn)率隨溫度升高的變化關(guān)系,如圖所示。
已知:
CO2的平衡轉(zhuǎn)化率=×100%n(CO2)初始-n(CO2)平衡n(CO2)初始
CH3OH的平衡產(chǎn)率=×100%n(CH3OH)平衡n(CO2)初始
①壓強(qiáng)p1p2(填“>”或“<”),原因。
②其中圖中縱坐標(biāo)表示CO2平衡轉(zhuǎn)化率的是圖(填“甲”或“乙”)。
③圖乙中T1溫度時(shí),兩條曲線幾乎交于一點(diǎn),分析原因。組卷:74引用:3難度:0.6 -
20.Na2SO3是一種重要的試劑,利用工業(yè)廢堿液(主要成分Na2CO3)吸收煙氣中的SO2并可獲得無水Na2SO3。
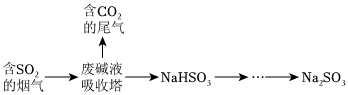
(1)吸收塔中發(fā)生反應(yīng)離子方程式,H2SO3的電離常數(shù)Ka1H2CO3的電離常數(shù)K′a1(填“<”或“>”)。
(2)向H2SO3溶液中滴加NaOH溶液,測得溶液中含硫微粒的物質(zhì)的量分?jǐn)?shù)隨pH變化如圖。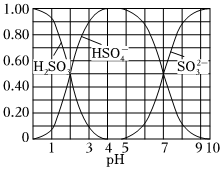
①由此可知NaHSO3溶液呈(填“酸性”或“堿性”)。
②寫出在水中存在的兩個(gè)平衡:ⅰHSO-3、ⅱ。這兩個(gè)平衡程度的大小關(guān)系是:ⅰⅱ。(填“<”或“>”)
(3)為了進(jìn)一步探究Na2SO3性質(zhì),兩個(gè)同學(xué)分別做了如下實(shí)驗(yàn),其中甲同學(xué)設(shè)計(jì)圖1裝置(鹽橋中為KCl),閉合開關(guān)后靈敏電流計(jì)指針發(fā)生偏轉(zhuǎn)。
①通過驗(yàn)證新產(chǎn)物也可以幫助確認(rèn)正、負(fù)兩極,驗(yàn)證電源正極生成物的實(shí)驗(yàn)操作方法是。
②閉合開關(guān)后鹽橋中的K+移向(填“左”或“右”)側(cè)的燒杯。
③負(fù)極的電極反應(yīng)。
④乙同學(xué)按圖2操作,并沒有出現(xiàn)預(yù)期的現(xiàn)象,而是溶液很快呈紅色。大約30mm后紅色變?yōu)槌壬?小時(shí)后變?yōu)辄S綠色。
因此,乙認(rèn)為剛開始一段時(shí)間并不涉及氧化還原反應(yīng)。
查閱資料:溶液中Fe3+、、OH-三種微粒會(huì)形成一種組成為的“配合物”并存在轉(zhuǎn)化關(guān)系:HOFeOSO2-3O2?HOFeO+4SO2+5SFe2++O2SO2-4
請從反應(yīng)速率和平衡的角度解釋原因。組卷:23引用:1難度:0.5


