2021-2022學年山東省濟南市萊蕪一中高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題意。
-
1.化學與生產、生活及社會發展密切相關。下列說法正確的是( )
A.二氧化硫有毒,嚴禁將其添加到任何食品和飲料中 B.將“84消毒液”與75%的酒精混合使用,消毒效果更好 C.“煤改氣”可以減少SO2等有害物質的排放量,有利于打贏藍天保衛戰 D.海水淡化可以解決淡水供應危機,向海水中加入明礬可以使海水淡化 組卷:5引用:2難度:0.8 -
2.下列物質的性質與用途均正確,且具有對應關系的是( )
A.氯氣具有漂白性,可用作自來水消毒劑 B.鈉具有很強的還原性,可用鈉與TiCl4溶液反應制取鈦 C.FeCl3溶液呈酸性,可用于刻蝕銅制電路板 D.Fe2O3呈紅棕色,可用作涂料 組卷:16引用:5難度:0.7 -
3.下列有關從海帶中提取碘的實驗原理和裝置能達到實驗目的的是( )
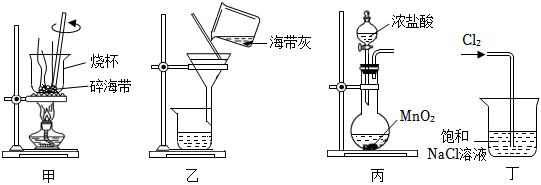
A.用裝置甲灼燒碎海帶 B.用裝置乙過濾海帶灰的浸泡液 C.用裝置丙制備用于氧化浸泡液中I-的Cl2 D.用裝置丁吸收氧化浸泡液中I-后的Cl2尾氣 組卷:1248引用:59難度:0.7 -
4.已知NA是阿伏加德羅常數的值,下列說法正確的是( )
A.0.1mol?L-1Na2CO3溶液中陰離子總數大于0.2NA B.5.6gFe與足量的S反應轉移的電子數為0.3NA C.D218O和T2O的混合物1.1g,含有的質子數為0.5NA D.0.1molH2和0.2molI2充分反應后分子總數小于0.3NA 組卷:8引用:2難度:0.7 -
 5.某科研小組設計了一種新型雙微生物燃料電池裝置,如圖所示。在a極將生活污水中的有機物(以C6H12O6為例)轉化為CO2,b極將酸性工業廢水中的硝酸鹽轉化為N2。下列說法不正確的是( )
5.某科研小組設計了一種新型雙微生物燃料電池裝置,如圖所示。在a極將生活污水中的有機物(以C6H12O6為例)轉化為CO2,b極將酸性工業廢水中的硝酸鹽轉化為N2。下列說法不正確的是( )A.a電極反應式為:C6H12O6-24e-+6H2O═6CO2↑+24H+ B.若b極產生了4.48L(已換算為標準狀況)的氣體,則穿過質子交換膜進入左室的H+數目為2NA C.電池工作時,電流由b極經負載流向a極,再經兩電解質溶液回到b極 D.若用該電池對鉛蓄電池進行充電,b極接PbO2極 組卷:93引用:6難度:0.6 -
6.利用圖示裝置進行實驗,能得出相應結論的是( )
溶液甲 固體乙 溶液丙 實驗結論

A 濃硝酸 Na2CO3 Na2SiO3 非金屬性:N>C>Si B 濃氨水 堿石灰 酚酞 NH3?H2O是弱堿 C 濃硫酸 Na2SO3 溴水 SO2具有漂白性 D 濃鹽酸 KMnO4 Na2S 氧化性:KMnO4>Cl2>S A.A B.B C.C D.D 組卷:16引用:3難度:0.6
三、非選擇題:本題共5小題,共60分。
-
19.硫代硫酸鈉晶體(Na2S2O3?5H2O,M=248 g?mol?1)是重要的化工原料,易溶于水,不溶于乙醇,具有較強的還原性和配位能力,在中性或堿性環境中穩定。某興趣小組用如圖裝置制備Na2S2O3?5H2O。

Ⅰ.制備Na2S2O3?5H2O
合成反應:SO2+Na2CO3═Na2SO3+CO2
2Na2S+3SO2═2Na2SO3+3S
Na2SO3+SNa2S2O3△
實驗步驟:裝置A制備的SO2通入裝置C中的混合溶液,加熱、攪拌,至溶液pH約為7時,停止通入SO2氣體,得產品混合溶液,經過分離提純得到Na2S2O3?5H2O產品。
(1)儀器A的名稱是,儀器B中長頸漏斗的作用是,另外可以通過裝置B觀察SO2的生成速率,其中的液體可以選擇。
a.濃H2SO4
b.飽和Na2SO3溶液
c.飽和NaHSO3溶液
d.飽和NaCl溶液
(2)裝置C中的反應混合溶液pH過低將導致產率降低,原因是(離子方程式表示)。
(3)產品混合溶液經_洗滌、干燥,得到Na2S2O3?5H2O產品。下列說法正確的是。
A蒸發濃縮至溶液表面出現晶膜時,停止加熱
B 快速蒸發溶液中水分,可得較大晶體顆粒
C 冷卻結晶后的固液混合物中加入乙醇可提高產率
D 可選用冷的Na2SO3溶液作洗滌劑
Ⅱ.Na2S2O3的應用
(4)Na2S2O3溶液常用作定影劑,溶去膠片上未感光的AgBr,該反應的離子方程式。組卷:15引用:1難度:0.9 -
20.低碳經濟成為人們一種新的生活理念,二氧化碳的捕捉和利用是一個重要研究方向,既可變廢為寶,又可減少碳的排放。工業上可用CO2和H2制備被譽為“21世紀的清潔燃料”二甲醚(CH3OCH3):如在500℃時、催化劑作用下,在密閉容器中將煉焦中的CO2轉化為二甲醚,其相關反應為:
主反應I:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)ΔH1
副反應II:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH2
(1)在一定溫度下某恒容密閉容器中按CO2和H2的濃度比為1:3投料進行反應,測得不同時間段部分物質的濃度如下表:
①下列情況能說明主反應I達到平衡狀態的是時間(min)/濃度(mol/L) 0 10 20 30 40 H2 1.00 0.68 0.40 0.30 0.30 CH3OCH3 0 0.05 0.08 0.10 0.10 (填字母)。
a.不再改變n(CO2)n(H2)
b.CO2的體積分數不再改變
c.混合氣體的密度不再改變
d.3σ(CO2)=σ(H2)
②0~20min內,CH3OCH3的平均反應速率σ(CH3OCH3)=。
③根據以上數據計算反應II的平衡常數K=(保留一位小數)。
(2)欲提高CH3OCH3產率,控制生產的關鍵因素是。
(3)對于反應Ⅱ,溫度對CO2的轉化率及催化劑的效率影響如圖所示:
下列有關說法正確的是。
A.溫度低于250℃時,隨溫度升高甲醇的產率一定減小
B.其他條件不變,若不使用催化劑,則250℃時CO2的轉化率可能位于M1
C.實際反應應盡可能在較低的溫度下進行,以提高CO2的轉化率
D.M1點時平衡常數比N點時平衡常數大組卷:7引用:1難度:0.4


