2022-2023學年河北省衡水二中高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、單選題:(共13個小題,每題2分,共26分。每小題只有一個選項符合題意。)
-
1.化學在生活、社會、環(huán)境和科技進步方面發(fā)揮著重要的作用。下列說法正確的是( )
A.針對新冠肺炎疫情,用無水酒精、雙氧水對環(huán)境進行殺菌消毒 B.殲20戰(zhàn)斗機采用大量先進復合材料、鋁鋰合金等,鋁鋰合金屬于金屬材料 C.“中國天眼”的鏡片材料為SiC,屬于新型有機非金屬材料 D.牙膏中添加氟化物可用于預防齲齒,原因是氟化物具有氧化性 組卷:16引用:1難度:0.8 -
2.小郡同學在做“典籍里的化學”項目研究時,收集到四個素材,從氧化還原的角度分析,其中一個與其他三個明顯不同。這個素材是( )
A.煮豆燃豆萁——曹植,《七步詩》 B.爆竹聲聲一歲除——王安石,《元日》 C.要留清白在人間——于謙,《石灰吟》 D.曾青得鐵則化為銅——淮南王劉安,《淮南萬畢術》 組卷:16引用:7難度:0.7 -
3.下列符號表征或說法正確的是( )
A.硫離子的結構示意圖: 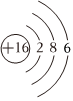
B.HClO結構式:H-Cl-O C.基態(tài)鉻原子的價層電子排布式:3d54s1 D.KOH電子式:  組卷:69引用:3難度:0.8
組卷:69引用:3難度:0.8 -
4.下列說法正確的是( )
A.2p能級有3個軌道 B.1s、2s、3s的電子云輪廓圖形狀不同 C.p軌道呈啞鈴形,因此p軌道上電子的運動軌跡呈啞鈴形 D.同一能層的p軌道電子能量不一定高于s軌道電子能量 組卷:48引用:2難度:0.8 -
5.下列有關光譜的說法中不正確的是( )
A.原子中的電子在躍遷時會發(fā)生能量的變化,能量的表現(xiàn)形式之一是光(輻射),這也是原子光譜產(chǎn)生的原因 B.原子只有發(fā)射光譜 C.通過原子光譜可以發(fā)現(xiàn)新的元素,也可以鑒定某些元素 D.霓虹燈光、激光、焰火都與電子躍遷釋放能量有關 組卷:18引用:2難度:0.6 -
6.四種元素的基態(tài)原子的電子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5,則下列有關比較中正確的是( )
A.原子半徑:④>③>②>① B.第一電離能:④>③>②>① C.電負性:④>③>②>① D.最高正化合價:④>③═②>① 組卷:52引用:3難度:0.7 -
7.下列對電子排布式或軌道表示式書寫的評價正確的是( )
選項 電子排布式或軌道表示式 評價 A N原子的軌道表示式: 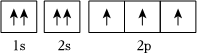
錯誤;違反洪特規(guī)則 B O原子的軌道表示式: 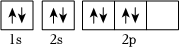
錯誤;違反泡利不相容原理 C K原子的軌道表示式:1s22s22p63s23p63d1 錯誤;違反能量最低原理 D Br-的電子排布式:[Ar]3d104s24p6 錯誤;違反能量最低原理 A.A B.B C.C D.D 組卷:103引用:8難度:0.7
三、非選擇題(共59分)
-
22.某實驗小組想探究實驗室用MnO2與鹽酸反應制取氯氣的反應條件,實驗裝置及藥品如下。
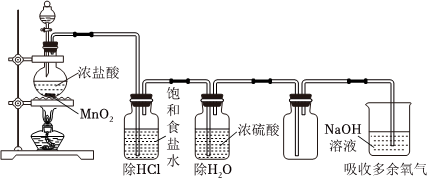
(1)寫出實驗室制氯氣的離子方程式。
(2)結合平衡移動原理,解釋飽和食鹽水的作用是。
(3)已知:不同溫度下MnO2與鹽酸反應的平衡常數(shù)
MnO2與鹽酸的反應是溫度t/℃ 50 80 110 平衡常數(shù)K 3.104×10-4 2.347×10-3 1.293×10-2 反應(填“放熱”或“吸熱”)。
(4)為探究條件對該反應的影響,小組同學設計并完成以下實驗:
①根據(jù)上述實驗可知MnO2與鹽酸產(chǎn)生氯氣的反應條件為序號 試劑 實驗操作 現(xiàn)象 實驗1 4mol/L鹽酸、MnO2 加熱 無明顯現(xiàn)象 實驗2 7mol/L濃鹽酸、MnO2 不加熱 無明顯現(xiàn)象 實驗3 7mol/L濃鹽酸、MnO2 加熱 產(chǎn)生黃綠色氣體 。
②針對實驗1和實驗3的現(xiàn)象,小組同學從電極反應角度分析物質氧化性和還原性的變化規(guī)律。
寫出實驗中制氯氣反應的電極反應式:
i.還原反應:MnO2+2e-+4H+═Mn2++2H2O
ii.氧化反應:。
提出假設:
ⅰ.增大c(H+),可以。
ⅱ.增大c(Cl-),可以增大Cl-的還原性。
③補充實驗,實驗Ⅱ、Ⅲ分別證實了②中的分析。
(固液混合物A為一定濃度的鹽酸和MnO2混合物;加熱裝置已略去)實驗序號 實驗操作 試劑 產(chǎn)物 Ⅰ 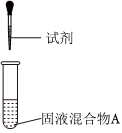
沒有添加新的試劑 無氯氣生成 Ⅱ 較濃a溶液 有氯氣生成 Ⅲ 固體b 有氯氣生成
較濃a溶液是,固體b是。組卷:13引用:3難度:0.6 -
23.某粗銅精煉得到的陽極泥主要成分為:Cu、Se、Ag2Se等,從中提取Se的工藝流程如圖:
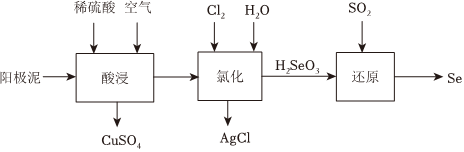
已知:
(1)酸浸過程,通入稀硫酸和空氣的目的是化學式 Ag2Se AgCl Ksp(常溫) 2.0×10-64 1.8×10-10 。
(2)“氯化”過程中發(fā)生如下轉化:
①Se轉化為H2SeO3,反應方程式為。
②Ag2Se轉化為AgCl,從化學平衡的角度解釋原因。
(3)“還原”過程中發(fā)生反應的化學方程式為。
(4)滴定法測定CuSO4溶液的濃度,其基本原理為:
第一步:2Cu2++4I-═2CuI↓+I2
第二步:2S2(無色)+I2═S4O2-3(無色)+2I-O2-6
①由此可知滴定所用的指示劑為。
②若CuSO4溶液體積為25mL,滴定至終點時消耗cmol/LNa2S2O3溶液VmL,則CuSO4溶液的物質的量濃度為mol/L。
③若第一步使用的KI溶液過量,對滴定結果的影響是。(填“偏大”或“偏小”或“不影響”)組卷:15引用:3難度:0.4


