2022-2023學年遼寧省沈陽120中高二(下)期末化學試卷
發布:2024/8/9 8:0:9
一.選擇題(每小題3分,共45分)
-
1.化學科學在國防裝備的打造中發揮著重要作用,下列說法錯誤的是( )
A.曳光彈尾部的曳光劑中加入銅粉,曳光彈可發出綠光 B.艦艇隱形涂料中使用的摻雜態聚乙炔為絕緣材料 C.涂在裝甲車上的聚氨酯偽裝涂料屬于有機高分子材料 D.隱形戰機表面的吸波陶瓷-碳化硅屬于新型復合材料 組卷:14引用:1難度:0.7 -
2.下列各組物質的分類正確的是( )
①水煤氣、冰醋酸、水玻璃、膽礬、干冰都是混合物
②含有氧元素的化合物叫氧化物
③CO2、NO2、P2O5均為酸性氧化物,Al2O3、CaO2為堿性氧化物
④同素異形體:C60、C70、金剛石、石墨
⑤強電解質溶液的導電能力一定強
⑥在熔化狀態下能導電的化合物為離子化合物
⑦有單質參加的反應或有單質生成的反應是氧化還原反應A.④⑥ B.①②⑤⑦ C.②③④⑥ D.全部正確 組卷:216引用:1難度:0.6 -
3.磁流體是電子材料的新秀,它既具有固體的磁性,又具有液體的流動性。制備時將含等物質的量的硫酸亞鐵和硫酸鐵的溶液混合,再滴入稍過量的氫氧化鈉溶液,隨后加入油酸鈉溶液,即可生成黑色的、分散質粒子直徑為36~55mm的磁流體。下列說法中正確的是( )
A.該磁流體是一種純凈物 B.該磁流體分散質粒子中存在共價鍵、離子鍵、氫鍵等 C.該磁流體很不穩定 D.所得的磁流體能產生丁達爾效應 組卷:71引用:2難度:0.7 -
4.下列離子組在給定條件下離子共存判斷及反應的離子方程式均正確的是( )
選項 條件 離子組 離子共存判斷及反應的離子方程式 A 滴加氨水 Na+、Al3-、Cl-、NO3- 不能大量共存,
Al3++3OH-═Al(OH)3↓B 由水電離出的H+濃度為1×10-12mol?L-1 NH4+、Na+、NO3-、Cl- 一定能大量共存,NH4++H2O?MH3?H2O+H+ C pH=1的溶液 Fe2+、Al3+、SO42-、MnO4- 不能大量共存,5Fe2++MnO4-+8H+═Mn2++5Fe3++4H2O D 通入少量SO2氣體 K+、Na+、ClO-、SO42- 不能大量共存,2ClO-+SO2+H2O═2HClO+SO32- A.A B.B C.C D.D 組卷:53引用:20難度:0.7 -
5.下列離子方程式表示正確的是( )
A.向KOH溶液中通入少量、過量H2S的離子方程式均為:H2S+2OH-=S2-+2H2O B.向FeBr2溶液中通少量、過量Cl2的離子方程式均為:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- C.向NaHCO3溶液中加入少量、過量Ba(OH)2溶液的離子方程式均為:Ba2++OH-+ =BaCO3↓+H2OHCO-3D.向C6H5ONa溶液中通入少量、過量CO2的離子方程式均為:H2O+CO2+C6H5O-→ +C6H5OHHCO-3組卷:57引用:3難度:0.8 -
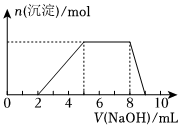 6.某溶液中可能含有如下離子:H+、Mg2+、Al3+、、Cl-、[Al(OH)4]-(不考慮水的電離)。當向該溶液中逐滴加入NaOH溶液時,產生沉淀的物質的量(n)與加入NaOH溶液的體積(V)的關系如圖所示,下列說法正確的是( )NH+4
6.某溶液中可能含有如下離子:H+、Mg2+、Al3+、、Cl-、[Al(OH)4]-(不考慮水的電離)。當向該溶液中逐滴加入NaOH溶液時,產生沉淀的物質的量(n)與加入NaOH溶液的體積(V)的關系如圖所示,下列說法正確的是( )NH+4A.原溶液中一定含有的陽離子是H+、Mg2+、Al3+、 NH+4B.原溶液中含有的陰離子是Cl-、[Al(OH)4]- C.原溶液中n(H+):n(Al3+):n( )=2:1:3NH+4D.反應最后形成的溶液中的溶質只含NaCl和Na[Al(OH)4] 組卷:41引用:4難度:0.5
二.填空題(共55分)
-
18.硼氫化鈉(NaBH4)通常為白色粉末,容易吸水潮解,可溶于異丙胺(熔點:-101℃,沸點:33℃),在有機合成中被稱為“萬能還原劑”。制備硼氫化鈉的流程如圖1。
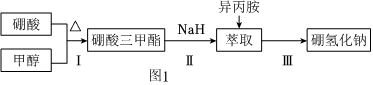
硼酸三甲酯的制備:將硼酸(H3BO3)和適量甲醇加入圓底燒瓶中,然后緩慢地加入濃硫酸,振蕩,在燒瓶上加裝分餾柱a,用電爐經水浴鍋加熱,回流2小時,收集硼酸三甲酯與甲醇共沸液。裝置如圖2所示(夾持裝置略去,下同)。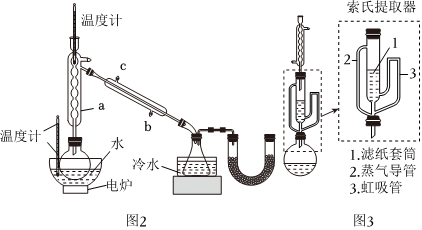
(1)直形冷凝管冷卻水應從硼酸三甲酯B(OCH3)3 甲醇 甲醇鈉 溶解性 與乙醇、甲醇混溶,能水解 與水混溶 溶于甲醇,不溶于異丙胺 沸點/℃ 68 64 450 硼酸三甲酯與甲醇混合物的共沸點為54℃ (填“b”或“c”)接口進入。
(2)濃硫酸的作用是。
(3)本實驗采用水浴加熱,優點是;U型管中試劑的作用是。
(4)在240℃條件下進行,硼酸三甲酯與氫化鈉反應制取NaBH4,同時生成CH3ONa,寫出該反應的化學方程式。
(5)萃取時可采用索氏提取法,其裝置如圖3所示。實驗時燒瓶中溶劑受熱蒸發,蒸汽沿導管2上升至球形冷凝管,冷凝后滴入濾紙套筒1中,進行萃取。萃取液液面達到虹吸管3頂端時,經虹吸管3返回燒瓶,從而實現連續萃取。當萃取完全后,硼氫化鈉在(填“圓底燒瓶”或“索氏提取器”)中。
(6)分離NaBH4并回收溶劑,采用的方法是。
(7)“有效氫含量”可用來衡量含氫還原劑的還原能力,定義是:每克含氫還原劑的還原能力相當于多少克H2的還原能力。NaBH4的有效氫含量為。(保留兩位小數)組卷:47引用:2難度:0.5 -
19.一種抑制類殺菌劑H的合成路線如圖:
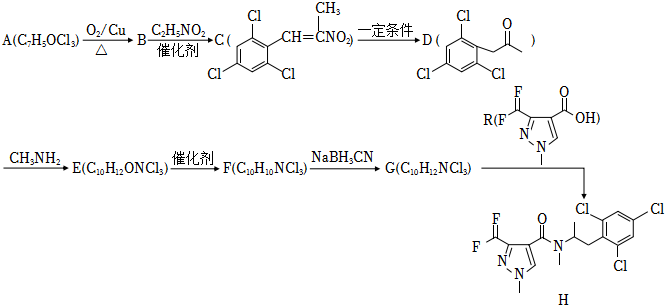
已知:
i:RCHI+CH3CH2NO2RCH=C(CH3)NO2催化劑
ii: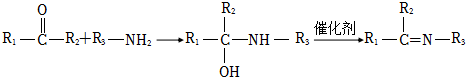 ?
?
回答下列問題:
(1)A的名稱為,G→H反應生成的官能團的名稱為。
(2)反應A→B的化學方程式為。
(3)F的結構簡式為。
(4)F→G的反應類型是。
(5)R的同分異構體中,滿足下列條件的有種。
①能與FeCl3溶液發生顯色反應;
②每1mol可消耗2molHCl;
③苯環上有6個取代基。
其中核磁共振氫譜峰面積之比為1:1:1的同分異構體的結構簡式為。組卷:37引用:1難度:0.5


