2021-2022學年北京市順義區楊鎮一中高三(上)期末化學模擬試卷(三)
發布:2024/4/20 14:35:0
一、選擇題:本題共16小題,每小題3分,共48分。每小題只有一個選項符合題意。
-
1.下列說法正確的是( )
A.第三能層有s、p共兩個能級 B.3d能級最多容納5個電子 C.第三能層最多容納8個電子 D.無論哪一能層的s能級最多容納的電子數均為2 組卷:169引用:4難度:0.8 -
2.反應3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)在一可變容積的密閉容器中進行,下列條件的改變對其反應速率幾乎無影響的是( )
A.將鐵片變成鐵粉 B.將容器的體積縮小一半 C.保持體積不變,充入N2使容器壓強增大 D.壓強不變,充入N2使容器體積增大 組卷:431引用:9難度:0.5 -
3.厭氧性硫酸鹽還原菌(SRB)是導致鐵腐蝕的一種菌種,其腐蝕原理的圖解如圖所示。下列說法不正確的是( )
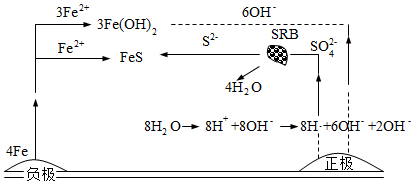
A.負極產生的Fe2+向正極移動 B.SO42-在SRB細菌作用下發生的反應為SO42-+8H? S2-+4H2OSRB菌C.總反應的化學方程式為4Fe+SO42-+4H2O FeS+3Fe(OH)2+2OH-SRB菌D.若引入新的菌種,則一定會加速金屬的腐蝕 組卷:66引用:2難度:0.5 -
4.下列溶液中導電性最強的是( )
A.1L 0.2mol?L-1 醋酸 B.0.1L 0.1mol?L-1 H2SO4溶液 C.0.5L 0.1mol?L-1 鹽酸 D.2L 0.1mol?L-1 H2SO3溶液 組卷:82引用:4難度:0.9 -
5.要實現反應:Cu+2HCl═CuCl2+H2↑,設計了下列四個實驗,你認為可行的是( )
A. 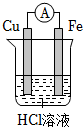
B. 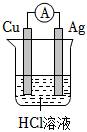
C. 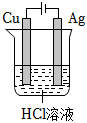
D. 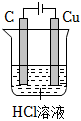 組卷:50引用:5難度:0.7
組卷:50引用:5難度:0.7 -
6.25℃和1.01×105Pa時,2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,該反應能自發進行的原因是( )
A.是吸熱反應 B.是放熱反應 C.是熵減少的反應 D.是熵增大的反應 組卷:223引用:8難度:0.9 -
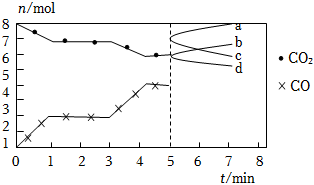 7.煉鐵的還原劑CO是由焦炭和CO2反應而得.現將焦炭和CO2放入體積為2L的密閉容器中,高溫下進行下列反應:C(s)+CO2(g)═2CO(g)△H=QkJ?mol-1.如圖為CO2、CO的物質的量n隨時間t的變化關系圖。下列說法正確的是( )
7.煉鐵的還原劑CO是由焦炭和CO2反應而得.現將焦炭和CO2放入體積為2L的密閉容器中,高溫下進行下列反應:C(s)+CO2(g)═2CO(g)△H=QkJ?mol-1.如圖為CO2、CO的物質的量n隨時間t的變化關系圖。下列說法正確的是( )A.0~1min,v(CO)=1mol?L-1?min-1;1~3min,v(CO)=v(CO2) B.當容器內的壓強不變時,反應一定達到平衡狀態, <1P(平衡)P(起始)C.3min時,溫度由T1升高到T2,則Q>0,再達平衡時, >1K(T2)K(T1)D.5min時再充入一定量的CO,a、b曲線分別表示n(CO)、n(CO2)的變化 組卷:112引用:4難度:0.7
三、非選擇題:本題共5小題,共52分。
-
20.減少氮的氧化物和碳的氧化物在大氣中的排放是環境保護的重要內容之一.
(1)已知:N2 (g)+O2 (g)=2NO (g)△H=+180.5kJ?mol-1
C(s)+O2 (g)=CO2 (g)△H=-393.5kJ?mol-1
2C (s)+O2(g)=2CO (g)△H=-221kJ?mol-1
若某反應的平衡常數表達式為:,c(N2)?c2(CO2)c2(NO)?c2(CO)
請寫出此反應的熱化學方程式.
(2)用CH4催化還原NOx可以消除污染,若將反應CH4+2NO2=CO2+2H2O+N2設計為原電池,電池內部是摻雜氧化釔的氧化鋯晶體,可以傳導O2-,則電池的正極反應式為.
(3)利用H2和CO2在一定條件下可以合成乙烯:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g) 已知不同溫度對CO2的轉化率及催化劑的效率影響如圖所示,下列有關說法不正確的是催化劑(填序號).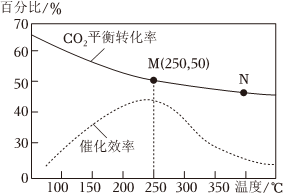
①不同條件下反應,N點的速率最大
②M點時平衡常數比N點時平衡常數大
③溫度低于250℃時,隨溫度升高乙烯的產率增大
④實際反應應盡可能在較低的溫度下進行,以提高CO2的轉化率
(4)在密閉容器中充入5mol CO和4mol NO,發生上述(1)中某反應,如圖為平衡時NO的體積分數與溫度、壓強的關系.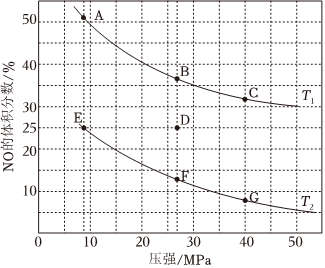
回答下列問題:
①溫度:T1T2(填“<”或“>”).
②某溫度下,若反應進行到10分鐘達到平衡狀態D點時,容器的體積為2L,則此時的平衡常數K=(結果精確到兩位小數);用CO的濃度變化表示的平均反應速率V(CO)=.
③若在D點對反應容器升溫的同時擴大體積至體系壓強減小,重新達到的平衡狀態可能是圖中A~G點中的點.組卷:44引用:6難度:0.3 -
21.將銅鋅合金溶解后與足量KI溶液反應(Zn2+不與I-反應),生成的I2用Na2S2O3標準溶液滴定,
根據消耗的Na2S2O3溶液體積可測算合金中銅的含量。實驗過程如下圖所示: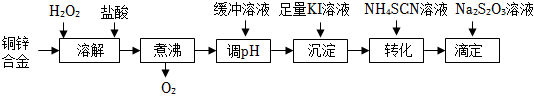
回答下列問題:
(1)H2O2的電子式為;“溶解”后銅元素的主要存在形式是(填離子符號)。
(2)“煮沸”的目的是除去過量的H2O2.298K時,液態過氧化氫分解,每生成0.01molO2放出熱量1.96kJ,
該反應的熱化學方程式為。
(3)用緩沖溶液“調PH”為了避免溶液的酸性太強,否則“滴定”時發生反應:S2+2H+═S↓+SO2↑+H2OO2-3
①該緩沖溶液是濃度均為0.10mol/L的CH3COOH和CH3COONH4的混合溶液。25℃時,溶液中各種離子濃度由大到小的順序為。[已知:25℃時,Ka(CH3COOH)=Kb(NH3?H2O)=1.8×10-5]
②若100mL Na2S2O3溶液發生上述反應時,20s后生成的SO2比S多3.2g,則v(Na2S2O3)=mol/(L?s)(忽略溶液體積變化的影響)。
(4)“沉淀”步驟中有CuI沉淀產生,反應的離子方程式為。
(5)“轉化”步驟中,CuI轉化為CuSCN,CuSCN吸附I2的傾向比CuI更小,使“滴定”誤差減小。沉淀完
全轉化后,溶液中c(SCN -):c(I-)≥。[已知:Ksp(CuI)=1.1×10-12;Ksp(CuSCN)=4.4×10-15]
(6)下列情況可能造成測得的銅含量偏高的是(填標號)。
A.銅鋅合金中含少量鐵 B.“沉淀”時,I2與I-結合生成:I2+I-=I-3I-3
C.“轉化”后的溶液在空氣中放置太久,沒有及時滴定 D.“滴定”過程中,往錐形瓶內加入少量蒸餾水。組卷:54引用:5難度:0.5


