2021-2022學(xué)年陜西省西安中學(xué)高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題
-
1.下列說法中錯誤的是( )
A.推廣使用新能源,可以減少二氧化碳等溫室氣體的排放 B.發(fā)電廠的燃煤在燃燒時加入適量石灰石,可減少二氧化硫排放 C.石油、煤、天然氣均屬于可再生的化石燃料 D.太陽能、氫能、風(fēng)能屬于清潔能源 組卷:35引用:10難度:0.9 -
2.下列變化屬于吸熱反應(yīng)的是( )
①液態(tài)水汽化
②將膽礬加熱變?yōu)榘咨勰?br />③濃硫酸稀釋
④氯酸鉀分解制氧氣
⑤生石灰跟水反應(yīng)生成熟石灰
⑥HCl在水溶液中的電離A.①④⑥ B.①②④ C.②③⑥ D.②④ 組卷:25引用:1難度:0.7 -
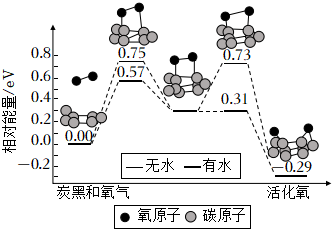 3.炭黑是霧霾中的重要顆粒物,研究發(fā)現(xiàn)它可以活化氧分子,生成活化氧,活化過程的能量變化模擬計算結(jié)果如圖所示。活化氧可以快速氧化二氧化硫。下列說法正確的是( )
3.炭黑是霧霾中的重要顆粒物,研究發(fā)現(xiàn)它可以活化氧分子,生成活化氧,活化過程的能量變化模擬計算結(jié)果如圖所示。活化氧可以快速氧化二氧化硫。下列說法正確的是( )A.每活化一個氧分子吸收0.29eV的能量 B.水可使氧分子活化反應(yīng)的活化能降低0.42eV C.氧分子的活化是C-O鍵的斷裂和O-O鍵的生成過程 D.炭黑顆粒是大氣中二氧化硫轉(zhuǎn)化為三氧化硫的催化劑 組卷:77引用:4難度:0.5 -
4.反應(yīng)N2(g)+3H2(g)?2NH3(g)△H<0,若在恒壓絕熱容器中發(fā)生,下列選項表明反應(yīng)一定已達(dá)平衡狀態(tài)的是( )
A.容器內(nèi)的溫度不再變化 B.容器內(nèi)的壓強(qiáng)不再變化 C.相同時間內(nèi),斷開H-H鍵的數(shù)目和生成N-H鍵的數(shù)目相等 D.容器內(nèi)氣體的濃度c(N2):c(H2):c(NH3)=1:3:2 組卷:256引用:34難度:0.5 -
5.在373K時,把0.1molN2O4氣體通入體積為1L的恒容密閉容器中,立即出現(xiàn)紅棕色。在60s時,體系已達(dá)平衡,此時容器內(nèi)壓強(qiáng)為開始時的1.6倍。下列說法錯誤的是( )
A.壓縮容器,顏色加深 B.在平衡時體系內(nèi)含N2O40.04mol C.以N2O4的濃度變化表示的平均反應(yīng)速率為0.001mol/(L?s) D.平衡時,如果再充入一定量N2O4,則可提高N2O4的轉(zhuǎn)化率 組卷:25引用:4難度:0.5 -
6.某溫度下,在2L的密閉容器中,加入1molX(g)和2molY(g)發(fā)生反應(yīng):X(g)+mY(g)?3Z(g),平衡時,X、Y、Z的體積分?jǐn)?shù)分別為30%、60%、10%,在此平衡體系中加入1molZ(g),再將達(dá)到平衡后,X、Y、Z的體積分?jǐn)?shù)不變.下列敘述不正確的是( )
A.m=2 B.兩次平衡的平衡常數(shù)相同 C.X與Y的平衡轉(zhuǎn)化率之比為1:1 D.第二次平衡時,Z的濃度為0.4mol?L-1 組卷:839引用:32難度:0.9
二、非選擇題
-
19.(1)在下列事實中,什么因素影響了化學(xué)反應(yīng)的速率?
①石灰石煅燒時要粉碎成細(xì)小的礦粒。
②熔化的 KClO3放出氣泡很慢,撒入少量MnO2,則很快產(chǎn)生氣體。
(2)依據(jù)實驗數(shù)據(jù),寫出下列反應(yīng)的熱化學(xué)方程式。
①在25℃、101 kPa 下,1g 甲醇燃燒生成CO2和液態(tài)水時放熱22.68 kJ。則表示甲醇燃燒熱的熱化學(xué)方程式為。
②發(fā)射衛(wèi)星時可用肼(N2H4)為燃料和二氧化氮(NO2)作氧化劑,兩者反應(yīng)生成氮氣和氣態(tài)水。已知:
N2(g)+2O2(g)=2NO2 (g)△H=+67.7kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ/mol ②
肼和二氧化氮反應(yīng)的熱化學(xué)方程式為。
(3)在5L的密閉容器內(nèi)充入10molA氣體和5molB氣體發(fā)生如下反應(yīng):2A( g )+B ( g )?2C( g ),2s后達(dá)到平衡,此時測得平衡混合物中C的濃度為0.6mol/L。則:
①用A的濃度變化表示該反應(yīng)的平均反應(yīng)速率。
②達(dá)到平衡后A的轉(zhuǎn)化率為。
③平衡混合物中B的濃度為。組卷:18引用:1難度:0.5 -
20.探究 CH3OH 合成反應(yīng)化學(xué)平衡的影響因素,有利于提高CH3OH的產(chǎn)率。以CO2、H2 為原料合成CH3OH 涉及的主要反應(yīng)如下:
Ⅰ.CO2( g )+3H2?CH3OH ( g )+H2O( g )△H1;K1
Ⅱ.CO ( g )+2H2( g )?СНЗOН( g )△H2;K2
Ш.CO ( g )+H2O ( g )=CO2( g )+H2( g )△H3;K3
回答下列問題:
(1)△H3=(用△H1、△H2表示);K3=(用 K1,K2 表示)。
(2)反應(yīng)Ⅰ、Ⅱ、Ⅲ以物質(zhì)的量分?jǐn)?shù)表示的平衡常數(shù) Kx 與溫度 T 變化關(guān)系如圖一所示。據(jù)圖判斷,△H1/△H2的數(shù)值范圍是(填標(biāo)號)。
A.<-1
B.-1~0
C.0~1
D.>1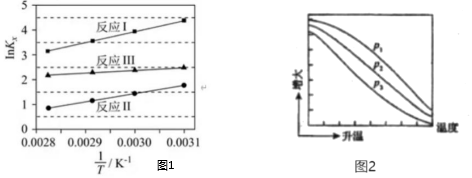
(3)一定條件下,只發(fā)生反應(yīng)1,原料初始組成=n(CO2)n(H2),反應(yīng)達(dá)到平衡時,體系的總壓強(qiáng)為10 MPa,此時СНЗОН的物質(zhì)的量分?jǐn)?shù)為 x (СНЗОН)=0.1,用各物質(zhì)的平衡分壓表示總反應(yīng)的平衡常數(shù),表達(dá)式 Kp=13(列出表達(dá)式);則CO2的轉(zhuǎn)化率為。
(4)不同壓強(qiáng)下,按照=1:3投料,實驗測定 СНЗОН的平衡產(chǎn)率( СНЗОН的平衡產(chǎn)率=n(CO2)n(H2)×100%)隨溫度的變化關(guān)系如圖二所示。壓強(qiáng) p1、p2、p3由大到小的順序為n(CH3OH)平衡n(CO2)初始;為同時提高CO2的平衡轉(zhuǎn)化率和 CH3OH 的平衡產(chǎn)率,應(yīng)選擇的反應(yīng)條件為(填標(biāo)號)。
A.低溫、高壓
B.高溫、低壓
C.低溫、低壓
D.高溫、高壓組卷:23引用:1難度:0.5


