2021年湖北省武漢市高考化學質檢試卷(4月份)
發布:2024/4/20 14:35:0
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.《易經》描述的“澤中有火”“上火下澤”,其中燃燒的氣體主要是( )
A.氫氣 B.一氧化碳 C.甲烷 D.乙烯 組卷:104引用:1難度:0.8 -
2.“嫦娥五號”帶回了富含氦-3的月壤,氦-3可作為未來可控核聚變(3He+3He→4He+21H)的清潔能源。下列說法正確的是( )
A.氦-3聚變屬于化學變化 B.3He和4He具有相同的性質 C.He位于第1周期第ⅡA族 D.2H和3He具有相同的中子數 組卷:35引用:2難度:0.8 -
3.化學實驗常對“紙”進行濕潤。下列說法正確的是( )
A.用濕潤的pH試紙測定氯化銨溶液的pH B.用濕潤的淀粉碘化鉀試紙檢驗氯氣 C.用濕潤的紅色石蕊試紙檢驗濃鹽酸的揮發性 D.將濾紙濕潤后置于漏斗中組裝成過濾器 組卷:9引用:1難度:0.5 -
4.下表中陳述Ⅰ和陳述Ⅱ均正確,且具有因果關系的是( )
選項 陳述Ⅰ 陳述Ⅱ A SO2具有抗氧化性且能殺菌消毒 葡萄酒中添加適量SO2 B 土壤膠體的膠粒一般帶正電荷 土壤具有保肥能力 C Na2O2可以與CO2反應產生O2 Na2O2可用于工業制氧氣 D Fe的金屬性比Sn的金屬性強 鍍錫鐵的鍍層破壞后能繼續保護鐵 A.A B.B C.C D.D 組卷:24引用:1難度:0.6 -
5.下列有關海水資源的開發利用方法中錯誤的是( )
A.在太陽能資源相對充足的沿海地區建造海水淡化廠 B.利用“海水→溴→溴化氫→溴”的流程生產溴 C.利用“海水→氫氧化鎂→氯化鎂→金屬鎂”的流程生產鎂 D.利用“海水→氯化鈉→金屬鈉→氫氧化鈉”的流程生產燒堿 組卷:61引用:2難度:0.8 -
6.一定條件下,有反應:Fe+6HCN+2K2CO3═K4[Fe(CN)6]+H2↑+2CO2↑+2H2O。下列說法正確的是( )
A.H2O與HCN分子間可形成氫鍵 B.HCN分子的電子式為 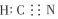
C.K2CO3中CO32-的空間構型為三角錐形 D.K4[Fe(CN)6]的中心離子的核外價層電子排布式為3d5 組卷:66引用:3難度:0.5
二、非選擇題:本題共4小題,共55分。
-
18.鋅是冶金、化工、紡織等行業應用廣泛的重要金屬之一。一種以含鋅煙塵(主要成分是ZnO,還含有少量Si、Cu、Cd、Pb、Sb等元素的氧化物)制備金屬鋅的工藝流程如圖。
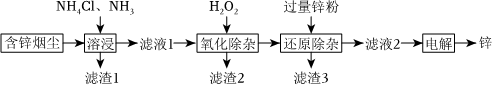
已知:“濾液1”含有的離子有[Zn(NH3)4]2+、[Cu(NH3)4]2+、[Cd(NH3)4]2+和。SbCl2-5
回答下列問題:
(1)基態鋅原子的價層電子軌道表示式(電子排布圖)為。
(2)“溶浸”中主要的化學方程式為。
(3)“濾渣1”的主要成分是PbO、。
(4)“濾渣2”是Sb2O5,“氧化除雜”的離子方程式為。
(5)“還原除雜”中加過量鋅粉的目的是。
(6)工業上一般利用閃鋅礦(主要成分是ZnS)為原料制備鋅,ZnS的晶胞結構如圖,則鋅的配位數為;已知晶胞參數為acm,該晶體的密度為g/cm3。(寫出計算式,設阿伏加德羅常數的值為NA)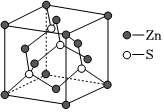 組卷:27引用:2難度:0.5
組卷:27引用:2難度:0.5 -
19.CH4—CO2重整技術是實現“碳中和”的一種理想的CO2利用技術,具有廣闊的市場前景、經濟效應和社會意義。該過程中涉及的反應如下。
主反應:CH4(g)+CO2(g)?2CO(g)+2H2(g)ΔH1
副反應:CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2=+41.0kJ/mol
回答下列問題:
(1)已知CH4、CO和H2的燃燒熱ΔH分別為-890.3kJ/mol、-283.0kJ/mol和-285.8kJ/mol,該催化重整主反應的ΔH1=kJ/mol。有利于提高CO2平衡轉化率的條件是。(填標號)
A.高溫高壓
B.高溫低壓
C.低溫高壓
D.低溫低壓
(2)在剛性密閉容器中,進料比分別等于1.0、1.5、2.0,且反應達到平衡狀態。n(CO2)n(CH4)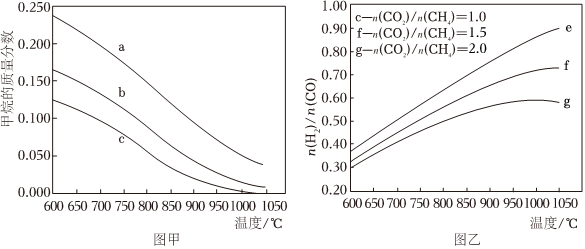
①甲烷的質量分數隨溫度變化的關系如圖甲所示,曲線c對應的=n(CO2)n(CH4)。
②反應體系中,隨溫度變化的關系如圖乙所示,隨著進料比n(H2)n(CO)的增加,n(CO2)n(CH4)的值n(H2)n(CO)(填“增大”、“不變”或“減小”),其原因是。
(3)在800℃、101kPa時,按投料比=1.0加入剛性密閉容器中,達平衡時甲烷的轉化率為90%,二氧化碳的轉化率為95%,則副反應的壓強平衡常數Kp=n(CO2)n(CH4)。(計算結果保留3位有效數字)
(4)我國科學家設計了一種電解裝置如圖丙所示,能將二氧化碳轉化成合成氣CO和H2,同時獲得甘油醛。則催化電極a為極,催化電極b產生CO的電極反應式為。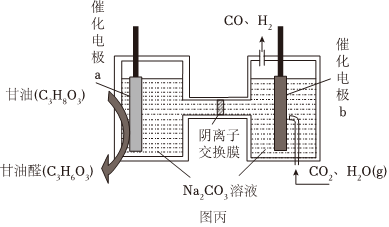 組卷:89引用:7難度:0.5
組卷:89引用:7難度:0.5


