2019-2020學年湖南省長沙市長郡中學高二(上)第一次模塊化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共5個小題,每小題2分,共10分.在每小題給出的四個選項中,只有一項是符合題目要求的.)
-
1.下列說法或表示方法正確的是( )
A.同溫同壓下,H2(g)+Cl2(g)=2HCl(g)在光照和點燃條件下的△H不同 B.放熱反應的反應速率總是大于吸熱反應的反應速率 C.蓋斯定律實質上是能量守恒定律的體現 D.H2(g)的燃燒熱△H=-285.8 kJ?mol-1,則2H2O(l)=2H2(g)+O2(g)△H=+285.8 kJ?mol-1 組卷:16引用:1難度:0.8 -
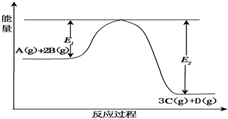 2.某可逆反應過程能量變化如圖所示,下列說法中正確的是( )
2.某可逆反應過程能量變化如圖所示,下列說法中正確的是( )A.該反應熱化學方程式為:A(g)+2B(g)?3C(g)+D(g)△H>0 B.其它條件不變,升高溫度,A的轉化率增大 C.其它條件不變,增大壓強,釋放熱量減少,平衡常數K減小 D.其它條件不變,加催化劑,反應速率增大,E1和E2均減小,△H不變 組卷:35引用:4難度:0.9
二、非選擇題
-
6.研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.
(1)已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ?mol-1
則反應NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=kJ?mol-1.
(2)一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是.
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變 d.每消耗1mol SO3的同時生成1molNO2
測得上述反應平衡時NO2與SO2體積比為1:6,則平衡常數K=.
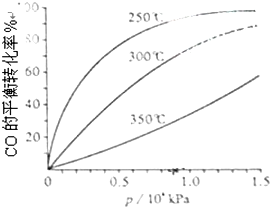
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)═CH3OH(g).CO在不同溫度下的平衡轉化率與壓強的關系如圖所示.該反應△H0(填“>”或“<”).實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是.組卷:13引用:2難度:0.5 -
7.已知Fe(s)+CO2(g)?FeO(s)+CO(g) K1①
Fe(s)+H2O(g)?FeO(s)+H2(g) K2②
H2(g)+CO2(g)?H2O(g)+CO(g) K3③
又已知不同溫度下,K1、K2值如表所示:
(1)若500℃時進行反應①CO2起始濃度為2mol?L-1,2min后建立平衡,則CO2轉化率為溫度/℃ K1 K2 500 1.00 3.15 700 1.47 2.26 900 2.40 1.60 。用CO表示的反應速率為。
(2)900℃進行反應③,其平衡常數K3為(求具體數值),焓變△H(填“>”“=“或“<”)0。
(3)如圖象符合反應②的是(填字母代號)(圖中v是速率,?為混合物中H2的體積百分量)。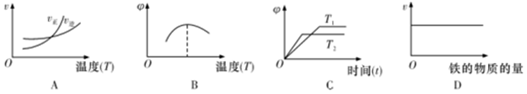 組卷:12引用:1難度:0.5
組卷:12引用:1難度:0.5


