2022-2023學年福建省廈門一中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共15小題,每小題3分,共45分,每小題只有一個選項符合題意)
-
1.化學與能源息息相關。下列說法錯誤的是( )
A.煤的干餾、氣化和液化都屬于化學變化 B.風能、電能、地熱能等都屬于一次能源 C.光合作用是將太陽能轉變為化學能的過程 D.鋅錳干電池和氫氧燃料電池都屬于一次電池 組卷:20引用:2難度:0.4 -
2.設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.30g乙烷完全燃燒斷開C-H鍵的數目為6NA B.氫氧燃料電池正極消耗22.4L(標準狀況)氣體時,電路中通過的電子數目為2NA C.0.1molH2和0.1molI2于密閉容器中充分反應后,HI分子的總數為0.2NA D.室溫下,1LpH=13的NaOH溶液中,由水電離的OH-離子數目為0.1NA 組卷:5引用:1難度:0.6 -
3.下列關于反應速率與反應限度的說法正確的是( )
A.鈉與水反應時,增加水的用量能明顯增大反應速率 B.合成氨工業采用循環操作的主要目的是提高平衡體系中氨的含量 C.催化劑能加快反應速率的原因是它能降低反應的活化能,減小反應的焓變 D.升溫能提高反應物的能量,增大反應物間的碰撞頻率,加快反應速率 組卷:17引用:3難度:0.7 -
4.利用下列實驗裝置進行的實驗不能達到相應實驗目的的是( )
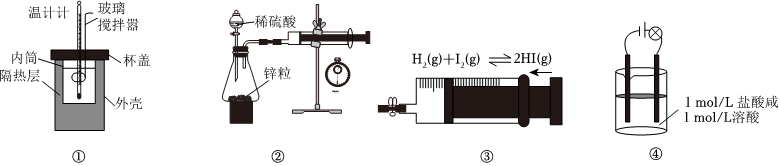
A.①測量中和反應的反應熱 B.②測量鋅與稀硫酸反應的反應速率 C.③探究壓強對平衡的影響 D.④證明醋酸為弱酸 組卷:17引用:3難度:0.5 -
5.下列有關電解質及其電離的說法正確的是( )
A.升溫促進水的電離,從而使水的pH值減小 B.氨水的導電性一定比NaOH溶液的導電性弱 C.某醋酸溶液的pH=4,說明醋酸是弱電解質 D.NaHCO3在水中能電離產生H+,故其溶液顯酸性 組卷:17引用:2難度:0.6 -
6.在T℃,HCl氣體通過鐵管時,發生腐蝕反應(X):反應X:Fe(s)+2HCl(g)?FeCl2(s)+H2(g)ΔH(K=0.33)。下列分析不正確的是( )
A.降低反應溫度,可減緩反應X的速率 B.在HCl氣體中加入一定量H2能起到防護鐵管的作用 C.反應X的ΔH可通過如下反應獲得:Fe(s)+Cl2(g)?FeCl2(s)ΔH1;H2(g)+Cl2(g)?2HCl(g)ΔH2 D.T℃時,若氣體混合物中c(HCl)=c(H2)=0.5mol?L-1,鐵管被腐蝕 組卷:118引用:9難度:0.5
二、非選擇題(本題包括4小題,共55分)
-
18.某化學小組利用酸性KMnO4與草酸(H2C2O4)反應,設計以下實驗探究化學反應快慢的影響因素。
實驗用品:0.04mol?L-1KMnO4溶液、0.2mol?L-1H2C2O4溶液、0.36mol?L-1稀硫酸、蒸餾水、MnSO4溶液、5mL量筒、膠頭滴管、井穴板、細玻璃棒及秒表等實驗內容及記錄:
回答下列問題:實驗編號 試管中所加試劑及用量/mL 溫度/℃ 紫色褪去所需時間/min H2C2O4溶液 KMnO4溶液 稀硫酸 蒸餾水 ① 2.0 1.0 1.0 2.0 20 4.1 ② 3.0 1.0 1.0 V1 20 3.7 ③ V2 1.0 1.0 2.0 80 t
(1)寫出酸性KMnO4與草酸反應的離子方程式。
(2)V1=mL,V2=mL,理由是。
(3)欲探究溫度對反應速率的影響,應選擇的實驗是(填編號)。
(4)為驗證“Mn2+對該反應有催化作用”,該小組同學用如圖裝置進行了實驗④和⑤,其中實驗所用酸性KMnO4溶液由0.36mol?L-1稀硫酸與0.04mol?L-1KMnO4溶液以體積比1:1混合所得。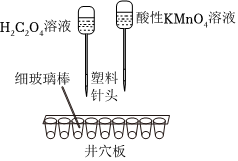
實驗④:向一個井穴中滴入10滴0.2mol?L-1H2C2O4溶液,逐滴加入酸性KMnO4溶液,并記錄各滴加入后的褪色時間。
實驗⑤:向三個井穴中分別滴加10滴0.2mol?L-1H2C2O4溶液,依次滴加1、2、3滴MnSO4溶液和3、2、1滴蒸餾水,攪拌均勻,再各滴加1滴酸性KMnO4溶液,并記錄褪色時間及混合體系顏色變化。
實驗記錄如下:
已知:MnO2為難溶于水的褐色固體;MnC2實驗④ KMnO4溶液 第1滴 第2滴 第3滴 第4滴 第5滴 紫色褪去所需時間/s 100 20 10 5 出現褐色沉淀 實驗⑤ MnSO4溶液 1滴 2滴 3滴 體系顏色變化:紅色→淺紅色→無色 蒸餾水 3滴 2滴 1滴 紫色褪去所需時間/s 12 16 16 溶液呈紅色,不穩定,會緩慢分解為Mn2+和CO2。O+4
i.實驗④中第5滴出現褐色沉淀可能的原因是(用離子方程式表示)。
ii.實驗④和⑤的現象驗證了“Mn2+對該反應有催化作用”,催化過程如下:MnO-4MnO2催化ⅠMn3+催化ⅡMn2+催化Ⅲ
實驗⑤中催化劑用量增加,褪色時間卻略有延長,說明催化劑過量易催化到“催化過程”的第步,反應過程出現紅色的原因是。組卷:26引用:3難度:0.3 -
19.采用廢鐵屑還原軟錳礦(軟錳礦主要成分是MnO2,還含有Fe2O3、MgO、SiO2和NiCO3雜質)來制備Mn的工藝流程如圖所示.
.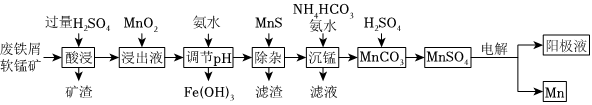
已知:生成氫氧化物的pH見下表
(1)“酸浸”前將原料粉碎的目的是離子 Fe2+ Fe3+ Mg2+ Ni2+ Mn2+ 開始沉淀的pH 7.5 2.7 8.1 7.7 8.3 完全沉淀的pH 9.7 3.7 9.4 8.4 9.8 .
(2)加入量MnO2的目的是,其反應的離子方程式為.
(3)常溫下,已知Kb(NH3?H2O)=4×10-5,則0.1mol/L的NH3?H2O的pH約為.(lg2=0.3).
(4)“調節pH”操作中pH控制范圍為.
(5)“沉錳”過程中的離子方程式為,其過程中溫度和pH對Mn2+和Mg2+沉淀率的影響如圖所示,由圖可知,“沉錳”的合適條件是.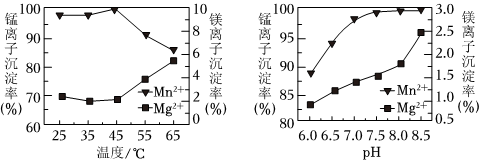
(6)該流程中可循環利用的物質是.組卷:15引用:1難度:0.3


