2022-2023學年廣東省佛山市順德區卓越高中(李兆基中學、華僑中學、順德一中西南學校、鄭裕彤中學)高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括16小題,共44分.其中1~10小題,每小題2分,共20分;11~16小題,每小題2分,共24分.每小題只有一個選項符合題意)
-
1.調控化學反應進行的快慢,對于工業生產和日常生活都有著十分重要的意義。在下列事實中,減慢化學反應速率的是( )


①古代冶鐵使用鼓風機 ②用冰箱冷藏食物 ③SO2轉化為SO3使用釩觸媒 ④食品包裝袋中放小袋鐵粉 A.①② B.③④ C.①③ D.②④ 組卷:29引用:3難度:0.5 -
2.下列說法正確的是( )
A.將盛有NH4HCO3粉末的小燒杯放入盛有少量醋酸的大燒杯中,然后向小燒杯中加入鹽酸,大燒杯中醋酸逐漸凝固,說明小燒杯中的反應是放熱反應 B.將鐵粉和碳粉混合后加熱,待反應一發生即停止加熱,反應仍可持續進行生成新物質硫化亞鐵,說明生成物總能量高于反應物的總能量 C.碳酸銨在室溫下就能自發地分解產生氨氣是因為外界給予了能量 D.Na與H2O的反應是熵增的放熱反應,該反應能自發進行 組卷:20引用:1難度:0.7 -
3.夏天蚊蟲在叮咬人時分泌的甲酸(HCOOH)會讓皮膚紅腫,能證明HCOOH是弱酸的實驗事實是( )
A.HCOOH溶液與Fe反應放出H2 B.0.1mol/LHCOOH溶液的pH大于1 C.用堿性肥皂水可以緩解痛癢 D.0.1mol/LHCOOH溶液可使紫色石蕊變紅 組卷:16引用:2難度:0.7 -
4.俄烏沖突爆發以來,北溪二號天然氣運輸管道被炸毀,歐洲能源價格暴漲。天然氣牽動人心,其主要成分是甲烷,下列能正確表示甲烷燃燒熱的熱化學方程式是( )
A.CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔH=-802.3kJ?mol-1 B.CH4(g)+2O2(g)═CO2(g)+2H2O(1)ΔH=-890.3kJ?mol-1 C. CH4(g)+2O2(g)═12CO2(g)+2H2O(1)ΔH=-445.15kJ?mol-112D.CH4(g)+ O2(g)═CO2(g)+2H2O(g)ΔH=-607.3kJ?mol-132組卷:11引用:1難度:0.7 -
5.關于中和熱的測定實驗,下列說法正確的是( )
A.在實驗中,溫度計只使用2次 B.向盛裝酸的燒杯中加堿時要小心緩慢以免灑出 C.用銅絲代替玻璃棒攪拌,會使測得的中和熱數值偏大 D.為了使反應進行的更完全,堿可適當過量 組卷:9引用:1難度:0.7 -
6.對于工業合成氨反應,下列有關有效碰撞理論和活化能的認識,不正確的是( )
A.增大H2濃度,活化分子百分數增大,單位時間生產效率提升 B.溫度升高,活化分子百分數增大,有效碰撞次數增加,故反應速率增大 C.選用適當的催化劑,活化分子百分數增加,有效碰撞次數增加,故反應速率增大 D.氮氣和氫氣的反應活化能很大,需要外界提供能量才可能發生反應 組卷:36引用:1難度:0.6
二、非選擇題:四個大題,每題14分,共計56分,考生根據要求作答.
-
19.甲烷水蒸氣催化重整是制備高純氫的方法之一.反應如下:
反應i.CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH2=+206kJ?mol-1;
反應ii.CH4(g)+2H2O(g)?CO2(g)+4H2(g)ΔH2=+165kJ?mol-1
回答下列問題:
(1)反應iii.CO2(g)+H2(g)?CO(g)+H2O(g)的ΔH3=kJ?mol-1;若在一定溫度下的容積固定的密閉容器中進行該反應,則可以提高CO2平衡轉化率的措施有(寫出一條即可).
(2)對于反應i,向體積為2L的恒容密閉容器中,按n(H2O):n(CH4)=1:1投料.
①若在恒溫條件下,反應達到平衡時CH4的轉化率為50%,則平衡時容器內的壓強與起始壓強之比為(最簡單整數比).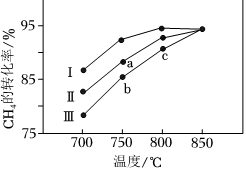
②其他條件相同時,在不同催化劑(Ⅰ、Ⅱ、Ⅲ)作用下,反應相同時間,CH4的轉化率隨反應溫度的變化如圖所示.a點(填“是”或“不是”)化學平衡狀態,CH4的轉化率:c點>b點,原因可能是.
(3)某科研小組研究了反應ⅱ的動力學,獲得其速率方程v=k[c(CH4)]m?,k為速率常數(只受溫度影響),m為CH4的反應級數.在某溫度下進行實驗,測得各組分初濃度和反應初速率如下:[c(H2O)]12
CH4的反應級數m=實驗序號 c(H2O)/mol?L-1 c(CH4)/mol?L-1 v/mol?L-1?s-1 1 0.100 0.100 1.2×10-2 2 0.100 0.200 2.4×10-2 ,當實驗2進行到某時刻,測得c(H2O)=0.040mol?L-1,則此時的反應速率V=mol?L-1?s-1(保留3位有效數字,已知≈0.3).0.1組卷:8引用:1難度:0.7 -
20.水煤氣變換反應CO(g)+H2O(g)?CO2(g)+H2(g)ΔH<0(簡稱WGS),在金屬催化劑Au(Ⅲ)表面上發生的所有基元反應步驟的活化能數值(單位:kJ/mol)如下表,其中*表示催化劑表面活性位,X*表示金屬表面活性位吸附物種.
(1)其他條件一定時,決定WGS反應速率的基元反應為基元反應 正逆反應活化能 E正反應(kJ/mol) E速反應(kJ/mol) ① H2O+*?H2O* 0 67 ② H2O*+*?OH*+H* 150 0 ③ OH*+*?O*+H* 71 67 ④ 2H*+*?H2+2* 74 25 ⑤ CO+*?CO* 0 42 ⑥ CO*+O*?CO2*+* 37 203 ⑦ CO2*?CO2+* 17 0 (填編號),基元反應CO*+O*?CO2*+*的焓變ΔH=kJ/mol.
(2)在進氣比[n(CO):n(H2O)]不同時,測得相應的CO的平衡轉化率如圖(圖中各點對應的溫度可能相同,也可能不同).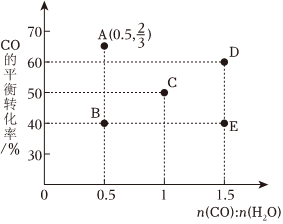
①往3L恒溫恒容的密閉容器中加入2.0molH2O(g)和30molCO,在D點溫度下,經過6min達到平衡,則該過程的平均反應速率v(H2O)=mol(L?min),此時的平衡常數Kc=.
②平衡從圖中B點移動到A點,應改變的條件是.
③連接圖中的點成線,表示相同溫度下CO平衡轉化率隨n(CO):n(H2O)的變化.
④圖中A、D兩點對應的反應溫度分別為TA和TD,通過計算分析,TATD(填“大于”“小于”或“等于”).組卷:6引用:1難度:0.6


