2021-2022學(xué)年山東省濟寧市鄒城市高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分.每小題只有一個選項符合題目要求.
-
1.國家主席習(xí)近平在2020年9月22日召開的聯(lián)合國大會上表示:“中國將力爭二氧化碳排放于2030年前達到峰值,在2060年前實現(xiàn)碳中和”.下列措施能促進“碳中和”的是( )
A.尋找更多的化石燃料,用來發(fā)電,將水電解產(chǎn)生氫氣 B.利用二氧化碳合成淀粉 C.將煤氣化和液化 D.大力使用清潔燃料天然氣(CH4) 組卷:6引用:2難度:0.6 -
2.下列物質(zhì)的分類組合中正確的是( )
A B C D 強電解質(zhì) NaOH NaCl CaCO3 HCl 弱電解質(zhì) BaSO4 NH3?H2O CH3COOH H2O 非電解質(zhì) SO2 金剛石 C2H5OH NH3 導(dǎo)電物質(zhì) 石墨 稀H2SO4 銅 固體KCl A.A B.B C.C D.D 組卷:54引用:3難度:0.6 -
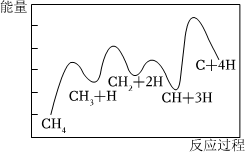 3.一定條件下,CH4分解形成碳的反應(yīng)歷程如圖所示.下列有關(guān)說法不正確的是( )
3.一定條件下,CH4分解形成碳的反應(yīng)歷程如圖所示.下列有關(guān)說法不正確的是( )A.該反應(yīng)為吸熱反應(yīng) B.該反應(yīng)歷程共分4步進行 C.第3步的正反應(yīng)活化能最小 D.第二步反應(yīng)的ΔH2小于第三步反應(yīng)的ΔH3 組卷:12引用:3難度:0.5 -
4.已知:①CH3OH的燃燒熱為725.76kJ?mol-1;
②中和熱為57.3kJ?mol-1;
③H2O(g)=H2O(l)ΔH=-44.0kJ?mol-1
下列熱化學(xué)方程式書寫正確的是( )A.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)ΔH=-725.76kJ?mol-1 B.NH3?H2O(aq)+H+(aq)=NH4+(aq)+H2O(l)ΔH=-57.3kJ?mol-1 C.CH3OH(l)+ O2(g)═CO2(g)+2H2O(g) ΔH═-637.76kJ?mol-132D.H2O(l)=H+(aq)+OH-(aq)ΔH=-57.3kJ?mol-1 組卷:176引用:6難度:0.7 -
5.下列說法不正確的是( )
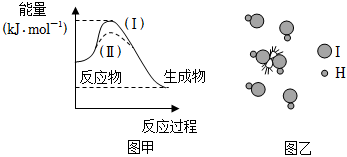
A.圖甲中,曲線Ⅱ表示反應(yīng)時加入了催化劑 B.加入催化劑,增大了單位體積內(nèi)反應(yīng)物分子中活化分子的數(shù)目,使得單位時間內(nèi)有效碰撞的次數(shù)增加 C.圖乙中HI分子發(fā)生了有效碰撞 D.HI溶液和NaOH溶液的反應(yīng)的活化能接近于零 組卷:170引用:3難度:0.5 -
6.用一質(zhì)量為1.2g的鋁片與45mL 4mol/L稀硫酸反應(yīng)制取H2,若要增大反應(yīng)速率,采取的措施:①再加入20mL 4mol/L硫酸;②改用30mL 6mol/L的稀硫酸;③改用20mL 18mol/L濃硫酸;④改用1.2g鋁粉代替1.2g鋁片;⑤適當(dāng)升高溫度;⑥在敞口容器中反應(yīng).其中正確的是( )
A.①②③④ B.②④⑤ C.②③④⑤ D.②④⑤⑥ 組卷:13引用:3難度:0.7 -
7.在一定溫度下發(fā)生反應(yīng):2NO2(g)?N2O4(g)ΔH<0,在密閉容器中達平衡后,改變下列條件達到新平衡后可使混合氣體顏色加深的是( )
A.縮小容器的容積 B.保持溫度壓強不變,充入NO2(g) C.降溫 D.保持容器容積不變,充入氮氣 組卷:15引用:3難度:0.7
三、非選擇題:本題共6小題,共60分
-
20.北京冬奧會火炬“飛揚”在研制的過程中,解決了火焰顏色與穩(wěn)定性、高壓儲氫、氫能安全利用等多項技術(shù)難題。中國研究人員研制出一種新型復(fù)合光催化劑,利用太陽光在催化劑表面實現(xiàn)高效分解水來制備氫氣,其主要過程如圖所示。

已知:幾種物質(zhì)中化學(xué)鍵的鍵能如表所示。
(1)寫出水蒸氣光催化反應(yīng)的熱化學(xué)方程式化學(xué)鍵 H2O中H-O鍵 O2中O=O鍵 H2中H-H 鍵H2O2中O-O鍵 H2O2中O-H鍵 鍵能kJ/mol 463 496 436 138 463 。
(2)過程Ⅲ屬于反應(yīng)(填“吸熱”或“放熱”)。
(3)分解產(chǎn)生的H2(g)可以與CO2(g)反應(yīng)用來合成甲醇,反應(yīng)的能量變化如圖所示。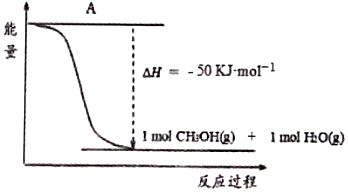
①補全上圖:圖中A處應(yīng)填入。
②該反應(yīng)需要加入銅—鋅基催化劑.加入催化劑后,該反應(yīng)的ΔH(填“變大”“變小”或“不變”)。
③已知:CO(g)+O2(g)=CO2(g)ΔH1=-283kJ?mol-112
H2(g)+O2(g)=H2O(g)ΔH2=-242kJ?mol-112
CH3OH(g)+O2(g)=CO2(g)+2H2O(g)ΔH3=-676kJ?mol-132
以CO(g)和H2(g)為原料合成甲醇的反應(yīng)為CO(g)+2H2(g)=CH3OH(g),該反應(yīng)的ΔH為kJ?mol-1。
(4)1909年哈伯在實驗室中首次利用氫氣與氮氣反應(yīng)合成氨,實現(xiàn)了人工固氮。
①請結(jié)合下列數(shù)據(jù)分析,工業(yè)上選用氮氣與氫氣反應(yīng)固氮,而沒有選用氮氣和氧氣反應(yīng)固氮的原因是。
②某實驗室在三個不同條件的1L密閉容器中,分別加入物質(zhì)的量均為n(N2)=0.100mol,n(H2)=0.300mol的反應(yīng)物進行合成氨反應(yīng),N2的物質(zhì)的量隨時間的變化如下圖a、b、c曲線所示。序號 化學(xué)反應(yīng) K(298K)的數(shù)值 ① N2(g)+O2(g)?2NO(g) 5×10-31 ② N2(g)+3H2(g)?2NH3(g) 4.1×106
實驗a剛好到達平衡時以H2表示的反應(yīng)速率為。
據(jù)如圖所示,c裝置中有一個條件與a不同。請指出,并說明判斷的理由。
c條件:理由:。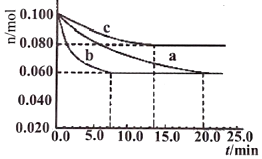 組卷:11引用:2難度:0.6
組卷:11引用:2難度:0.6 -
21.汽車尾氣是否為導(dǎo)致空氣質(zhì)量問題的主要原因,由此引發(fā)的“汽車限行”爭議,是當(dāng)前備受關(guān)注的社會性科學(xué)議題。
(1)反應(yīng)2CO(g)+2NO(g)?2CO2(g)+N2(g) ΔH=-620.9kJ?mol-1
可有效降低汽車尾氣污染物的排放.探究溫度、壓強(2MPa、5MPa)對該反應(yīng)的影響,如圖所示,表示5MPa的是(填標(biāo)號)。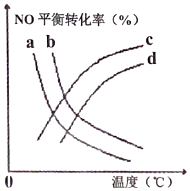
在一定溫度下,將2mol CO氣體和2mol NO通入恒容密閉容器中,發(fā)生以上反應(yīng)。
下列不能說明反應(yīng)達到平衡的是。
A.混合氣體的壓強不再改變的狀態(tài)
B.混合氣體的密度不再改變的狀態(tài)
C.單位時間內(nèi)生成2molNO同時消耗1molN2
D.混合氣體的平均相對分子質(zhì)量不再改變的狀態(tài)
(2)用NH3可以消除NO污染:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)ΔH<0
①某條件下該反應(yīng)速率v正=k正?c4(NH3)?c6(NO),v正=k正?ca(N2)?cb(H2O),若該反應(yīng)的平衡常數(shù)K=,則a=k正k逆,b=。
②在體積為1L的恒容密閉容器中加入4molNH3和5mol NO,在200℃時發(fā)生上述反應(yīng),測得NH3和N2的物質(zhì)的量隨時間變化如圖。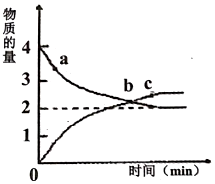
a點的正反應(yīng)速率c點的逆反應(yīng)速率(填“大于”、“小于”或“等于”);測得平衡時體系壓強為P0,則該反應(yīng)溫度下KP。(用含P0的式子表示,只列式不用化簡.用各氣體物質(zhì)的分壓替代濃度計算的平衡常數(shù)叫壓強平衡常數(shù)KP,某氣體的分壓=氣體總壓強×該氣體的物質(zhì)的量分數(shù))。
(3)若在相同時間內(nèi)測得NH3的轉(zhuǎn)化率隨溫度的變化曲線如下圖,200℃~700℃之間NH3的轉(zhuǎn)化率先升高又降低的原因是。800℃反應(yīng)達到平衡后,再向反應(yīng)體系中加入2molNO和2molH2O,平衡(填“正向移動”、“逆向移動”或“不移動”)。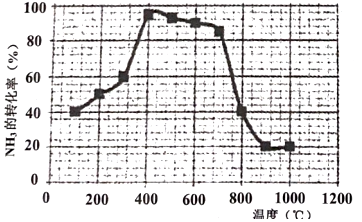 組卷:5引用:2難度:0.6
組卷:5引用:2難度:0.6


