2022-2023學(xué)年湖南省長沙市實(shí)驗(yàn)中學(xué)高一(上)第一次月考化學(xué)試卷
發(fā)布:2024/8/30 1:0:10
一、選擇題(本題共10小題,每小題3分,共30分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。)
-
1.下列物質(zhì)中,屬于純凈物的是( )
A.碘酒 B.稀鹽酸 C.Fe(OH)3 膠體 D.Na2CO3?10H2O 組卷:41引用:5難度:0.7 -
2.下列物質(zhì)不屬于電解質(zhì)的是( )
A.CH3COOH B.NH3?H2O C.NaClO D.C2H5OH 組卷:70引用:4難度:0.7 -
3.下列物質(zhì)的分類正確的是( )
堿 酸 鹽 堿性氧化物 酸性氧化物 A Na2CO3 H2SO4 Cu2(OH)2CO3 Fe2O3 SO3 B NaOH HCl NaCl Na2O2 CO C NaOH NaHSO4 CaF2 MgO SO2 D KOH HNO3 NaHCO3 CaO Mn2O7 A.A B.B C.C D.D 組卷:73引用:6難度:0.8 -
4.微納米材料研究所研發(fā)的納米量級(jí)碳酸鈣直徑約為30nm,已取得重大突破。下列有關(guān)說法正確的是( )
A.納米量級(jí)碳酸鈣是一種膠體 B.若將納米量級(jí)碳酸鈣均勻分散到蒸餾水中,會(huì)產(chǎn)生丁達(dá)爾效應(yīng) C.若將納米量級(jí)碳酸鈣均勻分散到蒸餾水中,不能透過濾紙 D.若將納米量級(jí)碳酸鈣加入稀鹽酸中,不會(huì)有二氧化碳產(chǎn)生 組卷:34引用:11難度:0.7 -
5.已知酸性HCl>CH3COOH>H2CO3>H2SiO3,下列方程式不符合強(qiáng)酸可制弱酸的是( )
A.CuSO4+H2S═CuS↓+H4SO4 B.2HCl+(CH3COO)2Ca═2CH3COOH+CaCl2 C.CaCO3+2HCl═CO2↑+CaCl2+H2O D.Na2SiO3+CO2+H2O═Na2CO3+H2SiO3 組卷:11引用:1難度:0.7 -
6.“探險(xiǎn)隊(duì)員”—硫酸,不小心走進(jìn)了有許多“吃人的野獸”(即能與硫酸發(fā)生化學(xué)反應(yīng)的物質(zhì))的小山,如圖所示逃生線路有多種,但有一種線路是完全行不通的,處處為陷阱,即為入口→③→⑤→⑦→⑨→出口,則該線路涉及的物質(zhì)為( )
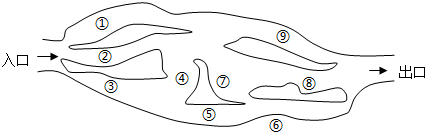
A.CO2、Cu、NaCl、CuO B.CO2、Cu、BaCl2、HCl C.Zn、Fe(OH)3、KNO3、CuO D.Na2CO3、Fe(OH)3、Zn、Fe2O3 組卷:35引用:2難度:0.7
三、填空題(本題共3小題,共34分)
-
17.有以下幾種物質(zhì):A.硝酸鉀固體;B.稀鹽酸;C.膽礬(CuSO4?5H2O)晶體;D.熔融的BaCl2;E.乙醇;F.氯氣;G.干冰;H.鋁;I.碳酸氫鈉固體;J.硫酸鉀溶液,按要求回答下列問題:
(1)①以上物質(zhì)中能導(dǎo)電的是(填字母,下同)。
②以上物質(zhì)中屬于電解質(zhì)的是。
③以上物質(zhì)中屬于氧化物的是。
④以上物質(zhì)中屬于混合物的是。
⑤以上物質(zhì)中屬于有機(jī)化合物的是。
(2)A溶于水的電離方程式為。
(3)B的水溶液與H反應(yīng)的離子方程式為。組卷:149引用:1難度:0.8
四、實(shí)驗(yàn)題(本題共1小題,共20分)
-
18.高鐵酸鉀(K2FeO4)是一新型、高效、無毒的多功能水處理劑。K2FeO4為紫色固體,微溶于KOH溶液,具有強(qiáng)氧化性,在酸性或中性溶液中快速產(chǎn)生O2,在堿性溶液中較穩(wěn)定;Fe3+遇KSCN溶液顯紅色。
(1)制備K2FeO4。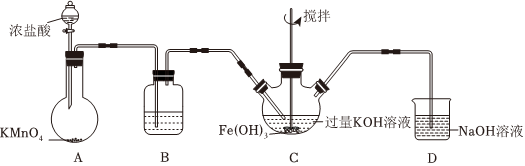
①C為制備K2FeO4裝置,KOH溶液過量的原因是。
②D為尾氣處理裝置,發(fā)生反應(yīng)的離子方程式為。
(2)探究K2FeO4的性質(zhì)。取C中紫色溶液,加入稀硫酸,產(chǎn)生黃綠色氣體,得溶液a,經(jīng)檢驗(yàn)氣體中含有Cl2。為證明K2FeO4能否氧化Cl-而產(chǎn)生Cl2,設(shè)計(jì)以下方案:
①由方案Ⅰ中溶液變紅可知a中含有方案Ⅰ 取少量溶液a,滴加KSCN溶液至過量,溶液呈紅色。 方案Ⅱ 用KOH溶液充分洗滌C中所得固體,再用KOH溶液將K2FeO4溶出,得到紫色溶液b.取少量b,滴加鹽酸有Cl2產(chǎn)生。 。該離子的產(chǎn)生(填“能”或不能)判斷一定是由K2FeO4被Cl-還原而形成的。
②方案Ⅱ得出氧化性:Cl2(填“>”或“<”)。FeO2-4
(3)使用時(shí)經(jīng)常通過測(cè)定高鐵酸鉀的純度來判斷其是否變質(zhì)。K2FeO4在硫酸溶液中反應(yīng)如下,配平及完成上述離子方程式:+FeO2-4H+═O2↑+Fe3++。組卷:33引用:2難度:0.5


