2021-2022學年遼寧省沈陽市回民中學高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一個選項符合題意)
-
1.化學與生產、生活密切相關。下列說法錯誤的是( )
A.小蘇打是面包發酵粉的主要成分之一 B.鐵粉可作為部分食品包裝袋內的脫氧劑 C.鋁合金是目前世界上用量最大的合金 D.Fe2O3俗稱鐵紅,常用作油漆、涂料的紅色顏料 組卷:10引用:3難度:0.7 -
2.下列敘述正確的是( )
A.在水溶液中能電離出H+的化合物不一定是酸 B.氯化鈉溶于水,在通電作用下才能電離出自由移動的離子 C.銅導電能力很強,所以銅是電解質 D.固體KNO3、液態H2SO4都不能導電,故它們都不是電解質 組卷:115引用:4難度:0.8 -
3.設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.2L0.5mol/LK2SO4溶液中陰離子所帶電荷數為NA B.2.0gH218O中所含中子數為NA C.Na2O2與水反應生成0.1mol O2時,轉移的電子數為0.4NA D.標準狀況下,2.24LN2和O2的混合氣體中的分子數為0.2NA 組卷:9引用:2難度:0.8 -
4.下列說法錯誤的是( )
A.分散系都是混合物 B.分散質粒子的直徑大小:濁液>膠體>溶液 C.向濃氨水中慢慢滴加足量的氯化鐵飽和溶液可制得氫氧化鐵膠體 D.當光束通過雞蛋清水溶液時,在與光束垂直的方向觀察到一條光亮的“通路”,說明雞蛋清水溶液屬于膠體 組卷:22引用:2難度:0.8 -
5.高鐵酸鉀(K2FeO4)是一種新型綠色消毒劑,主要用于飲用水處理。工業上制備K2FeO4的方法之一如下:
①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O②Na2FeO4+2KOH=K2FeO4+2NaOH下列說法錯誤的是( )A.K2FeO4中Fe為+6價,具有強氧化性,能殺菌消毒 B.反應①為氧化還原反應,反應②為非氧化還原反應 C.反應①中FeCl3體現還原性 D.反應①中NaClO是氧化劑,Na2FeO4是還原產物 組卷:17引用:2難度:0.6 -
6.下列有關離子檢驗的敘述正確的是( )
A.向溶液中滴加稀鹽酸,產生能使澄清石灰水變渾濁的無色無味氣體,則可判斷該溶液中含有CO32- B.向溶液中先加足量稀硝酸酸化,再加AgNO3溶液,產生白色沉淀,則可判斷該溶液中含有Cl- C.用潔凈的鉑絲蘸取待測液在酒精燈外焰上灼燒,觀察到火焰呈黃色,則可判斷該待測液中含有Na+,不含K+ D.用玻璃棒蘸取待測液點在紅色石蕊試紙上,試紙變藍,則可判斷該待測液顯酸性 組卷:28引用:3難度:0.7
二、非選擇題(本題共4小題,共55分)
-
18.氯及其化合物在化學實驗、實際生活、生產中應用廣泛,請完成以下內容。
(1)在常溫下實驗室制備少量氯氣的反應原理如下:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O①該反應中HCl體現的性質為(填字母)
A.氧化性
B.還原性
C.酸性
②用單線橋法表示該反應電子轉移的方向和數目。
2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O
③寫出實驗室用MnO2制備Cl2的化學方程式,根據以上信息判斷MnO2、KMnO4、Cl2的氧化性由強到弱的順序為。
(2)加入氧化劑可以實現下列物質轉化的是(填字母)。
A.ClO2→NaCl
B.NaClO→Cl2
C.HCl→Cl2
D.HClO3→KClO3
(3)實驗室常用燒堿溶液吸收Cl2尾氣,若將Cl2通入熱的燒堿溶液中,可以得到NaCl、NaClO和NaClO3的混合液。當混合液中NaClO和NaClO3的物質的量之比為5:1時,則被氧化的氯原子與被還原的氯原子的物質的量之比為。
(4)我國從2000年起逐步用ClO2代替Cl2對飲用水進行消毒。工業上用NaClO3和SO2在酸性條件下反應制備ClO2,已知SO2被氧化為SO42-,寫出該反應的離子方程式;若反應中產生0.1molClO2,轉移的電子數為。組卷:33引用:2難度:0.5 -
19.電子工業常用30%的FeCl3溶液腐蝕附在絕緣板上的銅箔制造印刷電路板。
(1)寫出FeCl3溶液與金屬銅反應的離子方程式。
(2)某小組采取下列步驟從使用過的腐蝕廢液中回收銅,并重新獲得FeCl3溶液: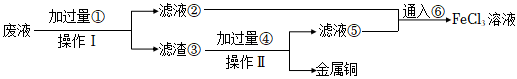
ⅰ.操作Ⅰ和操作Ⅱ使用到的主要玻璃儀器有。
ⅱ.若某腐蝕液中含1.5mol/LCuCl2、3.0mol/LFeCl2、1.0mol/LFeCl3,取200mL腐蝕液按上述步驟回收銅,為充分回收銅,加入①的質量最小為。
ⅲ.向濾液②中加入NaOH溶液的現象是。
(3)實驗室里保存FeCl2溶液時,常加入鐵釘或鐵粉防止Fe2+被氧化,請用離子方程式說明其原因。
(4)下列各圖示中能較長時間觀察到Fe(OH)2的是(填字母)。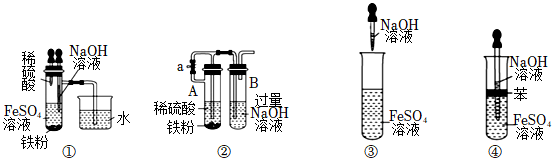
A.①②③
B.①②④
C.①②③④
D.②③④
(5)在查閱資料后,有同學認為Fe(OH)2被空氣中的氧氣氧化后生成Fe3(OH)8,Fe3(OH)8中n(Fe2+):n(Fe3+)=。組卷:29引用:2難度:0.6


