2012-2013學年四川省成都七中高二(下)入學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共15小題,每小題4分,滿分60分)
-
1.下列過程或現象與鹽類的水解無關的是( )
A.加熱氯化鐵溶液的顏色變深 B.CaCO3的飽和溶液pH約為9.3 C.0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L D.NaHCO3做發酵粉時加入檸檬酸后效果更好 組卷:17引用:5難度:0.9 -
2.某溫度下,100mL 0.4mol/L醋酸溶液與足量Zn粒反應生成H2的速率v(H2)=0.01mol/(L?min).為了減緩反應速率,但又不影響生成H2的總量,下列有關說法正確的是( )
A.可向該溶液中加少量CaCO3固體 B.可向該溶液中加入10 mL 0.1 mol/L醋酸溶液 C.可向該溶液中加入少量NaNO3溶液 D.若向該溶液中加入少量醋酸鈉固體,反應速率可能變成v(H2)=0.3 mol/(L?h) 組卷:26引用:2難度:0.9 -
3.下列說法正確的是( )
A.氯氣、硫酸鋇和氨水分別屬于非電解質、強電解質和弱電解質 B.體積不同但pH相同的醋酸和鹽酸,分別用蒸餾水稀釋至原體積的m倍和n倍,稀釋后兩溶液的pH仍相同,而m和n無法確定相對大小 C.CuCl2+2H2O?Cu(OH)2+2HCl,加入少量硝酸銀固體后可以增大CuCl2水解程度 D.用來配制標準NaOH溶液的NaOH固體含有少量的KOH,此時中和測得鹽酸的濃度數值一定偏高 組卷:3引用:1難度:0.9 -
4.在NaHSO4溶液中離子的總濃度為0.06mol/L,若加入等體積離子濃度為0.06mol/L的Ba(OH)2溶液,混合后溶液的體積不變,則溶液的pH值為( )
A.2 B.1.7 C.12 D.12.3 組卷:6引用:2難度:0.7 -
5.常溫下,下列溶液中可能大量共存的離子組是( )
A.加入金屬鎂能產生H2的溶液中:Na+、Fe2+、SO42-、NO3- B.含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42- C.能使Al3+生成沉淀的溶液中:NH4+、Na+、SiO32-、HCO3- D.水電離產生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- 組卷:147引用:10難度:0.7 -
6.室溫下,下列變化后的溶液pH小于8的是( )
A.pH=10的氨水稀釋100倍 B.pH=4的醋酸和pH=10的NaOH等體積混合 C.pH=8的NaOH溶液與pH=8的Ba(OH)2等體積混合 D.pH=11的NaOH溶液與pH=5的鹽酸等體積混合 組卷:6引用:3難度:0.7
二、解答題(共4小題,滿分40分)
-
18.25℃,濃度都是1mol/L的四種正鹽溶液,其pH情況如下:
(1)AY溶液pHAX BX AY BY pH=7,c(X-)=1mol/L pH=4 pH=6 7 (填“>”、“<”或“=”);
(2)將等濃度的HX、HY稀釋相同的倍數,溶液的pH變化幅度:HXHY;若將等體積、等pH的AOH、BOH溶液在稀釋時pH均下降2,則加水量:AOHBOH(均填“>”、“<”或“=”);
(3)在BX溶液中:c(B+)+c(H+)-c(OH-)=mol/L;
在AY溶液中:c(A+)-c(Y-)=(用一項表示)=(用兩項表示);
(4)A2Z的水解方程式是;.組卷:43引用:3難度:0.5 -
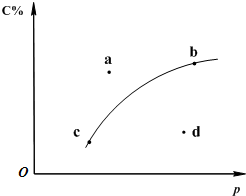 19.對于可逆反應2A(?)+B(g)?2C(g);如圖是其它條件一定時反應中C的百分含量與壓強的關系曲線。回答下列問題:
19.對于可逆反應2A(?)+B(g)?2C(g);如圖是其它條件一定時反應中C的百分含量與壓強的關系曲線。回答下列問題:
(1)物質A的狀態是(填“氣體”、“液體”或“固體”);
(2)圖中a、b、c、d四點中表示未達到平衡狀態且v正<v逆的點是;
(3)在a、b、c三種條件下達平衡時,v(a)、v(b)、v(c)按由大到小排序;
(4)對于2SO2(g)+O2(g)?2SO3(g);△H=-198kJ/mol。在實際生產過程中,原料氣中SO2為7%(體積分數)、O2為11%,常壓下進行,控制溫度在450℃左右。
請問原料氣中SO2與O2的體積比不是2:1,而要7:11(大約2:3)的原因是;如果在恒容容器中,僅把另外82%的其他氣體“抽出來”,是否會減小SO2的轉化率(填“會”或“不會”)。組卷:85引用:1難度:0.3


