人教版(2019)選擇性必修1《第1章 化學反應的熱效應》2020年單元測試卷(B卷)
發布:2024/4/20 14:35:0
-
1.下列關于熱化學反應的描述中正確的是( )
A.HCl和NaOH反應的中和熱△H=-57.3 kJ?mol-1,則H2SO4和Ca(OH)2反應的反應熱為△H=2×(-57.3)kJ?mol-1 B.CO(g)的燃燒熱是283.0 kJ?mol-1,則2CO2(g)═2CO(g)+O2(g)△H=+566 kJ?mol-1 C.一定條件下,將0.5mol N2(g)和1.5molH2(g)置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 D.1 mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱 組卷:86引用:2難度:0.9 -
2.反應M+Z→Q(△H<0)分兩步進行:①M+Z→X(△H>0),②X→Q(△H<0)。下列示意圖中,能正確表示總反應過程中能量變化的是( )
A. 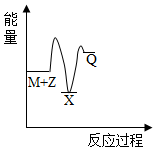
B. 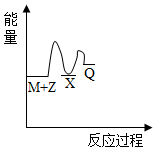
C. 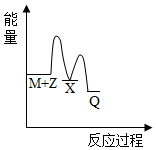
D. 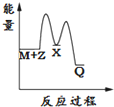 組卷:16引用:16難度:0.9
組卷:16引用:16難度:0.9 -
3.2018年10月22日,中國科學家王中林院士獲世界能源領域最高獎-被譽為“能源界諾貝爾獎”的埃尼獎(EniAward),以表彰他在納米發電機和 海洋“藍色能源”技術領域對世界能源發展做出的重大貢獻。下列與海洋能一樣屬于可再生能源的是( )
A.氫氣 B.煤 C.石油 D.天然氣 組卷:17引用:2難度:0.8 -
4.下列說法或表示方法不正確的是( )
A.蓋斯定律實質上是能量守恒定律的體現 B.在稀溶液中:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3 kJ/mol,若將含0.5mol H2SO4的濃硫酸與含1mol NaOH的溶液混合,放出的熱量大于57.3kJ C.由一定條件下石墨合成金剛石吸熱可知,石墨比金剛石穩定 D.在101kPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒的熱化學方程式表示為:2H2(g)+O2(g)═2H2O(l)ΔH=-285.8kJ/mol 組卷:40引用:3難度:0.7 -
5.已知充分燃燒a g乙炔氣體時生成1mol二氧化碳氣體和液態水,并放出熱量b kJ,則乙炔燃燒的熱化學方程式正確的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=-4b kJ/mol B.C2H2(g)+ O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol52C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol 組卷:99引用:45難度:0.7 -
6.已知H2O2在催化劑作用下分解速率加快,其能量隨反應進程的變化如下圖所示.下列說法正確的是( )
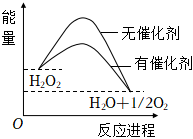
A.加入催化劑,減小了反應的熱效應 B.加入催化劑,可提高H2O2的平衡轉化率 C.H2O2分解的熱化學方程式:H2O2=H2O+ O2+Q12D.反應物的總能量高于生成物的總能量 組卷:633引用:9難度:0.9 -
7.NF3是一種溫室氣體,其存儲能量的能力是CO2的12 000~20 000倍,在大氣中的壽命可長達740年,如表所示是幾種化學鍵的鍵能:下列說法中正確的是( )
化學鍵 N≡N F-F N-F 鍵能/kJ?mol-1 946 154.8 283.0 A.過程N2(g)→2N(g)放出能量 B.過程N(g)+3F(g)→NF3(g)放出能量 C.反應N2(g)+3F2(g)═2NF3(g)的△H>0 D.NF3吸收能量后如果沒有化學鍵的斷裂與生成,仍可能發生化學反應 組卷:50引用:13難度:0.6 -
8.已知某些共價鍵的鍵能如下表所示,火箭燃料肼(N2H4)的燃燒的熱化學方程式是:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-5 akJ?mol-1則O-H的鍵能為( )
共價鍵 N-N N-H O=O N≡N 鍵能kJ?mol-1 3a 2.5a 4a 8a A.2a kJ?mol-1 B.2.5a kJ?mol-1 C.3a kJ?mol-1 D.3.5a kJ?mol-1 組卷:46引用:3難度:0.7
-
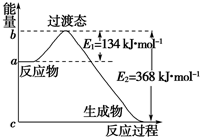 23.根據要求回答下列問題:
23.根據要求回答下列問題:
(1)如圖是1mol NO2(g)能量和1mol CO(g)反應生成CO2和NO過程中的能量變化示意圖,若在反應體系中加入催化劑,反應速率增大,E1的變化是(填“增大”、“減小反應過程小”或“不變”,下同),△H的變化是。
(2)0.1mol Cl2與焦炭、TiO2完全反應,生成一種還原性氣體和一種易水解成TiO2?xH2O的液態化合物,放熱4.28kJ,該反應的熱化學方程式為。
(3)甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的兩種反應的熱化學方程式如下:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ?mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=-192.9kJ?mol-112
已知③H2O(g)═H2O(l)△H=-44kJ?mol-1,則甲醇蒸氣燃燒為液態水的熱化學方程式為。
(4)在微生物作用的條件下,NH4+經過兩步反應被氧化成NO3-,這兩步的能量變化如圖。第二步反應是(填“放熱”或“吸熱”)反應,1mol NH4+(aq)全部氧化成NO2-(aq)的熱化學方程式是。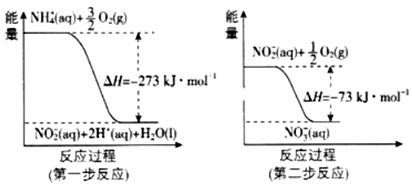 組卷:18引用:2難度:0.6
組卷:18引用:2難度:0.6 -
 24.CH4、H2、C都是優質的能源物質,它們燃燒的熱化學方程式為:
24.CH4、H2、C都是優質的能源物質,它們燃燒的熱化學方程式為:
①CH4(g)+2O2(g)═CO2(g)+2H2O(1)ΔH=-890.3kJ?mol-1
②2H2(g)+O2(g)═2H2O(1)ΔH=-571.6kJ?mol-1
③C(s)+O2(g)═CO2(g)ΔH=-393.5kJ?mol-1
(1)在深海中存在一種甲烷細菌,它們依靠酶使甲烷與O2作用產生的能量存活,甲烷細菌使1mol甲烷生成CO2氣體與液態水,放出的能量(填“>”、“<”或“=”)890.3kJ。
(2)甲烷與CO2可用于合成合成氣(主要成分是一氧化碳和氫氣):CH4+CO2═2CO+2H2,1g CH4完全反應可釋放15.46kJ的熱量,則:若將物質的量均為1mol的CH4與CO2充入某恒容密閉容器中,體系放出的熱量隨著時間的變化如圖所示,則CH4的轉化率為。
(3)C(s)與H2(g)不反應,所以C(s)+2H2(g)═CH4(g)的反應熱無法直接測量,但通過上述反應可求出C(s)+2H2(g)═CH4(g)的反應熱ΔH=。
(4)目前對于上述三種物質的研究是燃料研究的重點,下列關于上述三種物質的研究方向中可行的是。(填字母)
A.尋找優質催化劑,使CO2與H2O反應生成CH4與O2,并放出熱量
B.尋找優質催化劑,在常溫常壓下使CO2分解生成碳與O2
C.尋找優質催化劑,利用太陽能使大氣中的CO2與海底開采的CH4合成合成氣(CO、H2)
D.將固態碳合成為C60,以C60作為燃料組卷:24引用:5難度:0.7


