2018-2019學年北京市西城區月壇中學高二(上)期中化學試卷
發布:2024/10/31 15:30:2
一、選擇題:(每題只有一個正確選項,每題2分,共50分)
-
1.下列設備工作時,將化學能轉化為電能的是( )
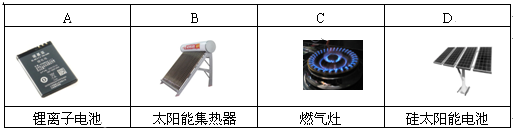
A.A B.B C.C D.D 組卷:103引用:27難度:0.7 -
2.下列反應既屬于氧化還原反應,又屬于吸熱反應的是( )
A.鋁片和稀鹽酸反應 B.Ba(OH)2?8H2O與NH4Cl的反應 C.甲烷在氧氣中的燃燒反應 D.灼熱的碳與二氧化碳的反應 組卷:65引用:31難度:0.7 -
3.下列反應類型中屬于化學平衡主要研究對象的是( )
A.化合反應 B.離子反應 C.可逆反應 D.氣體反應 組卷:152引用:8難度:0.9 -
4.下列與化學反應能量變化相關的敘述正確的是( )
A.生成物總能量一定低于反應物總能量 B.放熱反應的反應速率總是大于吸熱反應的反應速率 C.應用蓋斯定律,可計算某些難以直接測量的反應焓變 D.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H不同 組卷:1193引用:169難度:0.9 -
5.反應4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L的密閉容器中進行,半分鐘后,NO的物質的量增加了0.3mol,則此反應的平均速率可表示( )
A.v(O2)=0.010 mol?L-1?s-1 B.v(NO)=0.008 mol?L-1?s-1 C.v(H2O)=0.006 mol?L-1?s-1 D.v(NH3)=0.002 mol?L-1?s-1 組卷:42引用:5難度:0.7 -
6.反應C(s)+H2O(g)?CO(g)+H2(g)△H>0.在容積可變的密閉容器中進行,下列條件對其反應速率幾乎無影響的是( )
A.升高溫度 B.將容器的體積縮小一半 C.增加C的量 D.降低溫度 組卷:7引用:3難度:0.7 -
7.提高能源的利用率已成為國際能源研究的熱點課題.下列相關措施使用不當的是( )
A.使燃料充分燃燒 B.合理使用能源 C.加強能源利用的科技投入 D.加大能源開采力度 組卷:18引用:3難度:0.7 -
8.下列熱化學方程式中,能夠表示物質燃燒熱的是( )
A.C(s)+ O2(g)=CO(g)△H=-110.5 kJ/mol12B.H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ/mol C.H2(g)+ O2(g)=H2O(g)△H=-241.8 kJ/mol12D.C8H18(l)+ O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ/mol252組卷:73引用:5難度:0.9 -
9.已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ?mol-1,則反應HCl(g)=
2H2(g)+12Cl2(g)的△H為( )12A.+184.6kJ?mol-1 B.+92.3kJ?mol-1 C.-184.6kJ?mol-1 D.-92.3kJ?mol-1 組卷:21引用:15難度:0.9 -
10.含20.0克NaOH的稀溶液與稀鹽酸反應,放出28.7kJ的熱量,表示該反應中和熱的熱化學方程式正確的是( )
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=+28.7kJ/mol B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-28.7kJ/mol C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=+57.4kJ/mol D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ/mol 組卷:39引用:2難度:0.9
二、非選擇題(31題每空1分,其余每空2分,共50分)
-
31.反應C+H2O═CO+H2,在一可變的容積的密閉容器中進行,試回答:
(1)增加C的量,其正反應速率的變化是(填“增大”、“不變”或“減小”,以下相同)。
(2)將容器的體積縮小一半,其正反應速率,逆反應速率,平衡移動(填“向正反應方向”、“向逆反應方向”或“不”,以下相同)。
(3)保持體積不變,充入N2使體系壓強增大,其正反應速率,逆反應速率,平衡移動。
(4)保持壓強不變,充入N2使容器的體積增大,其正反應速率,逆反應速率,平衡移動。組卷:118引用:2難度:0.5 -
 32.化工原料A,在一定條件下發生下列反應:2A(g)?4B (g)+c(g),△H>0
32.化工原料A,在一定條件下發生下列反應:2A(g)?4B (g)+c(g),△H>0
某溫度下,向容積為1L的密閉容器中充入0.5molA(g),發生上述反應。反應過程中A(g) 的濃度隨時間變化如圖所示。
請回答:
(1)0-500s內,v(A)=mol/(L?s)。
(2)僅升高溫度,平衡向(填“正”或“逆“)反應方向移動。
(3)平衡時,A的轉化率是
(4)該溫度下,此反應的化學平衡常數數值為組卷:11引用:2難度:0.6


