2022-2023學年廣東省廣州二中高二(上)期中化學試卷
發布:2024/11/20 19:30:3
一、選擇題:本題包括16小題,1-10題每小題2分,11-16題每題4分,共44分。每小題只有一個選項符合題意。
-
1.下列說法錯誤的是( )
A.水能、風能、生物質能是可再生能源,煤、石油、天然氣是不可再生能源 B.“冰,水為之,而寒于水”,說明相同質量的水和冰相比較,冰的能量低 C.同溫同壓下,4Al(s)+3O2(g)=2Al2O3(s)在常溫和點燃條件下的ΔH不同 D.反應物和生成物具有的總能量的高低,決定了該反應是放熱還是吸熱反應 組卷:4引用:3難度:0.6 -
2.下列有關說法正確的是( )
A.增大反應物濃度,反應物分子中單位體積活化分子數增多,活化分子百分數增大 B.H2(g)+Br2(g)?2HBr(g)在恒溫恒壓下進行,向容器中通入Ar(g),化學反應速度減小 C.對于反應H2NCOONH4(s)?CO2(g)+2NH3(g),在反應容器中投入一定量H2NCOONH4固體,反應一段時間后,當CO2的體積分數不再改變時,該反應達到了化學平衡狀態 D.100mL2mol?L-1的鹽酸與鋅反應時,加入適量的NaCl溶液,生成H2的速度不變 組卷:16引用:1難度:0.7 -
3.在實驗室進行中和熱測定實驗,下列有關敘述錯誤的是( )
A.大小燒杯之間塞滿碎泡沫,目的是減少熱量損失 B.測量終止溫度時,應當記錄混合溶液的最高溫度 C.為了使酸堿充分反應,應當緩慢分次倒入NaOH溶液并攪拌 D.可用塑料材質的環形攪拌棒代替環形玻璃攪拌棒 組卷:27引用:8難度:0.7 -
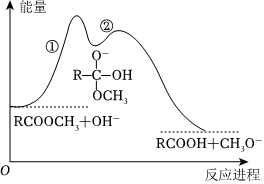 4.酯在堿溶液中水解反應歷程如圖所示。下列說法錯誤的是( )
4.酯在堿溶液中水解反應歷程如圖所示。下列說法錯誤的是( )A.活化能:反應①>反應② B.反應①和②、總反應的ΔH都小于0 C.反應①決定酯在堿溶液中水解的總速率 D.其他條件相同,增大堿的濃度能提高酯水解速率 組卷:7引用:3難度:0.6 -
5.下列實驗方案不能達到相應實驗目的的是( )
A. 
用裝置①定量測定化學反應速率B. 
用裝置②探究H2SO4濃度對化學反應速率的影響C. 
用裝置③探究催化劑對H2O2分解速率的影響D. 
用裝置④證明鋁片與鹽酸的反應為放熱反應組卷:6引用:1難度:0.5 -
6.在密閉容器中,一定條件下,進行如下反應:NO(g)+CO(g)?
N2(g)+CO2(g)△H=-373.2kJ/mol,達到平衡后,為提高該反應的速率和NO的轉化率,采取的正確措施是( )12A.加催化劑同時升高溫度 B.加催化劑同時增大壓強 C.升高溫度同時充入NO D.降低溫度同時增大壓強 組卷:82引用:4難度:0.8
二、非選擇題:本題包括4小題,共56分
-
19.(Ⅰ)某探究小組用HNO3與大理石反應過程中質量減小的方法,研究影響反應速率的因素。所用HNO3濃度為1.00mol/L、2.00mol/L,大理石有細顆粒和粗顆粒兩種規格,實驗溫度為25℃、35℃,每次實驗HNO3的用量為25.00mL,大理石用量為10.00g。
(1)請完成以下實驗設計表,并在實驗目的一欄中填空:
(2)實驗①中CO2質量隨時間變化的關系見圖。計算實驗①中70s~90s范圍內用HNO3表示的平均反應速率實驗編號 溫度(℃) 大理石規格 HNO3濃度(mol/L) 實驗目的 ① 25 粗顆粒 2.00 (Ⅰ)實驗①和②探究濃度對反應速率的影響;
(Ⅱ)實驗①和③探究溫度對反應速率的影響;
(Ⅲ)實驗①和④探究對反應速率的影響。② 25 粗顆粒 a ③ b 粗顆粒 2.00 ④ c 細顆粒 d (忽略溶液體積變化,不需要寫出計算過程)。在0~70、70~90、90~200各相同的時間段里,反應速率最大的時間段是。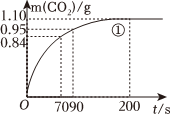
(Ⅱ)某小組利用H2C2O4溶液和硫酸酸化的KMnO4溶液反應來探究“外界條件對化學反應速率的影響”。實驗時通過測定酸性KMnO4溶液褪色所需時間來判斷反應的快慢。該小組設計了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
(3)表中V1=實驗編號 0.1mol?L-1酸性KMnO4溶液的體積/mL 0.6mol?L-1H2C2O4溶液的體積/mL H2O的體積/mL 實驗溫度/℃ 溶液褪色所需時間/min ① 10 V1 35 25 ② 10 10 30 25 ③ 10 10 V2 50 mL,V2=mL。
(4)探究溫度對化學反應速率影響的實驗編號是(填編號,下同),可探究反應物濃度對化學反應速率影響的實驗編號是。
(5)實驗①測得KMnO4溶液的褪色時間為2min,忽略混合前后溶液體積的微小變化,這段時間內平均反應速率v(H2C2O4)=mol?L-1?min-1。組卷:32引用:3難度:0.7 -
20.以天然氣(CH4)為原料合成甲醇(CH3OH)。有關熱化學方程式如下:
①2CH4(g)+O2(g)═2CO(g)+4H2(g)ΔH1=-70.8kJ?mol-1
②CO(g)+2H2(g)?CH3OH(g)ΔH2
③2CH4(g)+O2(g)?2CH3OH(g)ΔH3=-251.0kJ?mol-1
(1)ΔH2=kJ?mol-1。反應①自發進行的條件是(填序號)。
a.高溫
b.低溫
c.任何環境都自發
d.任何環境都不自發
(2)在體積可變的密閉容器中投入1molCO和2molH2,在不同條件下發生反應:CO(g)+2H2(g)?CH3OH(g)。實驗測得平衡時CH3OH的物質的量隨溫度、壓強的變化如圖所示。
①M點時,H2的轉化率為;壓強:p1p2(填“>”、“<”或“=”)。
②反應速率:N點v正(CO)M點v逆(CO)(填“>”、“<”或“=”)。
③溫度為506℃時,若壓強為p1、在密閉容器中進行上述反應(起始投料不變),平衡時容器體積為1L,則平衡常數K=(用分數表示)。在不同溫度下上述反應的平衡常數的對數(lgK)如圖2所示,則B、C、D、E四點中能正確表示該反應的lgK與T的關系的點為(填字母)。
④在2L恒容密閉容器中充入a(a>0)molH2、2molCO和6molCH3OH(g),在506℃下進行上述反應。為了使該反應逆向進行,a的范圍為。組卷:0引用:1難度:0.7


