2014-2015學年福建省龍巖市永定縣高陂中學高二(上)化學寒假作業
發布:2024/11/28 4:0:2
一、單項選擇題
-
1.生產、生活離不開各種化學物質,下列說法不正確的是( )
A.用純堿治療胃酸過多 B.不需要通過化學反應能從海水中獲得食鹽和淡水 C.加熱至70℃以上能殺死H7N9禽流感病毒是因為病毒的蛋白質受熱變性 D.生產發泡餐具的主要材料聚苯乙烯屬于高分子化合物 組卷:2引用:1難度:0.8 -
2.下列關于電解質溶液的敘述正確的是( )
A.常溫下,同濃度的NaHCO3與Na2CO3溶液相比,Na2CO3溶液的pH值較小 B.常溫下,pH=7的NH4Cl與氨水的混合溶液中:c(Cl-)>c( )>c(H+)=c(OH-)NH+4C.常溫下,往同濃度的NaCl與NaBr溶液中,滴加AgNO3溶液先生成淡黃色沉淀,說明Ksp(AgCl)<Ksp(AgBr) D.在滴有酚酞的Na2CO3溶液中,加入適量BaCl2溶液后溶液褪色 組卷:2引用:1難度:0.8 -
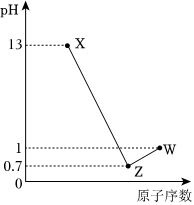 3.已知短周期元素A、B、C、D最高價氧化物對應水化物分別為X、Y、Z、W.A是短周期中原子半徑最大的元素.常溫下X、Z,W均可與Y反應,A、C、D的原子序數及0.1 mol/LX、Z、W溶液的pH如圖所示.下列說法正確的是( )
3.已知短周期元素A、B、C、D最高價氧化物對應水化物分別為X、Y、Z、W.A是短周期中原子半徑最大的元素.常溫下X、Z,W均可與Y反應,A、C、D的原子序數及0.1 mol/LX、Z、W溶液的pH如圖所示.下列說法正確的是( )A.B的離子半徑大于A的離子半徑 B.C氫化物穩定性大于D氫化物穩定性 C.X、W兩物質含有的化學鍵類型相同 D.B原子的電子層數與最外層電子數相等 組卷:48引用:5難度:0.7 -
 4.下列各組物質按如圖所示轉化關系每一步都能一步實現的是
4.下列各組物質按如圖所示轉化關系每一步都能一步實現的是
( )甲 乙 丙 丁 A FeCl3 FeCl2 Fe2O3 Fe(OH)3 B Cu CuO CuSO4 CuCl2 C C CO CO2 H2CO3 D NH3 NO NO2 HNO3 A.A B.B C.C D.D 組卷:124引用:20難度:0.9 -
5.鎂及其化合物一般無毒(或低毒)、無污染,且鎂原電池放電時電壓高而平穩,使鎂原電池越來越成為人們研制綠色原電池的關注焦點。其中一種鎂原電池的反應為:xMg+Mo3S4
MgxMo3S4,下列說法錯誤的是( )放電充電A.放電時,負極反應為Mg-2e-=Mg2+ B.放電過程中Mg2+向正極遷移 C.放電時,每1 mol Mo3S4發生反應失去2x mol e- D.充電時,陽極反應為MgxMo3S4-2xe-=Mo3S4+xMg2+ 組卷:7引用:1難度:0.7 -
6.將pH=2的鹽酸與pH=12的氨水等體積混合,在所得的混合溶液中,下列關系式正確的是( )
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) B.c(NH4+)>c(Cl-)>c(OH-)>c(H+) C.c(Cl-)=c(NH4+)>c(H+)=c(OH-) D.c(NH4+)>c(Cl-)>c(H+)>c(OH-) 組卷:96引用:5難度:0.7 -
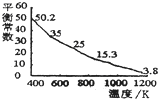 7.碘單質難溶于小卻易溶于KI溶液.碘水中加入KI溶液發生反應:I2(aq)+I-(aq)?I3-(aq),該反應的平衡常數與溫度的關系如圖,下列說法不正確的是( )
7.碘單質難溶于小卻易溶于KI溶液.碘水中加入KI溶液發生反應:I2(aq)+I-(aq)?I3-(aq),該反應的平衡常數與溫度的關系如圖,下列說法不正確的是( )A.上述正反應為放熱反應 B.上述體系中加入苯,平衡不移動 C.可運用該反應原理除去硫粉中少量的碘單質 D.實驗室配制碘水時,為增大碘單質的溶解度可加入適量KI溶液 組卷:76引用:9難度:0.7 -
8.下列關于化學與生產、生活的認識正確的是( )
A.加快化石燃料的開采與使用,有利于節能減排、保護環境 B.葡萄糖溶液不能產生丁達爾現象,不屬于膠體 C.催化法處理汽車尾氣的原理可表示為:CO+NO C+NO2催化劑D.明礬是一種水處理劑,可用于水的消毒、殺菌 組卷:0引用:1難度:0.8 -
9.下列關于有機物的認識正確的是( )
A.油脂、葡萄糖、蛋白質都是人體重要的營養物質,它們都會水解 B.分子組成為CH4或C2H6O的有機物都不存在同分異構現象 C.只用新制的Cu(OH)2懸濁液可以鑒別乙酸溶液、葡萄糖溶液和淀粉溶液 D.乙烯和乙醇完全燃燒時,生成的二氧化碳與水的物質的量之比均為1:1 組卷:2引用:1難度:0.6 -
10.根據元素周期表和元素周期律,下列推斷正確的是( )
A.HF、HCl、HBr、HI的酸性逐漸增強,說明F、Cl、Br、I的非金屬性逐漸增強 B.元素R最高正價為+7價,表明R元素屬于ⅦA族元素 C.若M+和R2-具有相同的電子層結構,則原子半徑:M<R D.從元素在周期表中的位置可以推斷,硅和鍺都可用作半導體材料 組卷:13引用:6難度:0.7 -
11.常溫下,10mL濃度為amol?L-1的醋酸溶液pH=4.下列能使溶液的pH=7的措施是( )
A.將溶液稀釋到 10L B.將溶液與10mL濃度為amol?L-1的NaOH溶液混合 C.將溶液與10mL、pH=10的NaOH溶液混合 D.往溶液中加入適量的氫氧化鈉,使溶液中c(Na+)=c (CH3COO-) 組卷:6引用:5難度:0.9 -
12.下列有關化學實驗的說法錯誤的是( )
A.為了除去NaCl溶液中的MgCl2,可加氫氧化鈉溶液至溶液呈中性 B.稀釋濃硫酸時,將水沿燒杯內壁注入濃硫酸中,并用玻璃棒不斷攪拌 C.某試樣與NaOH濃溶液共熱,產生使濕潤紅色石蕊試紙變藍的氣體,則試樣中含有 NH+4D.做完實驗后,剩余的金屬鈉應放回試劑瓶以消除安全隱患 組卷:0引用:2難度:0.7 -
13.在給定條件下,下列物質的制取可以實現的是( )
A.鹽鹵(含MgCl2) Mg(OH)2石灰乳MgCl2溶液鹽酸無水MgCl2蒸發灼燒B.鋁土礦 AlO2-NaOH溶液Al(OH)3足量鹽酸Al2O3△C.NH3 NOO2催化劑、加熱NO2O2HNO3H2O空氣D.NaCl溶液 Cl2電解無水FeCl2Fe組卷:21引用:2難度:0.5
二、填空題
-
38.鐵及其化合物有重要用途,如聚合硫酸鐵[Fe2(OH)n(SO4)3-n/2]m是一種新型高效的水處理混凝劑,而高鐵酸鉀(其中鐵的化合價為+6)是一種重要的殺菌消毒劑,某化學探究小組設計如下方案制備上述兩種產品:
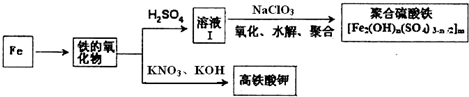
請回答下列問題:
(1)檢驗固體鐵的氧化物中鐵的化合價,應使用的試劑是(填標號)
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高錳酸鉀溶液
(2)在溶液Ⅰ中加入NaClO3,寫出其氧化Fe2+的離子方程式:。
(3)Fe2O3與KNO3和KOH的混合物加熱共融可制得高鐵酸鉀。完成并配平下列化學方程式:Fe2O3+KNO3+KOH-+KNO2+
(4)為測定溶液I中鐵元素的總含量,實驗操作:準確量取20.00mL溶液I于帶塞錐形瓶中,加入足量H2O2,調節pH<3,加熱除去過量H2O2;加入過量KI充分反應后,再用0.1000mol?L-1Na2S2O3標準溶液滴定至終點,消耗標準溶液20.00mL。
已知:2Fe3++2I-═2Fe2++I2
I2+2S2O32-═2I-+S4O62-
①寫出滴定選用的指示劑,滴定終點觀察到的現象。
②溶液Ⅰ中鐵元素的總含量為g?L-1.若滴定前溶液中H2O2沒有除盡,所測定的鐵元素的含量將會(填“偏高”“偏低”“不變”)。組卷:2引用:1難度:0.5 -
39.黃銅礦是工業煉銅的主要原料,其主要成分為CuFeS2,現有一種天然黃銅礦(含少量SiO2),為了測定該黃銅礦的純度,某同學設計了如下實驗:
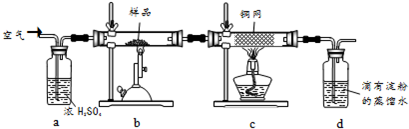
現稱取研細的黃銅礦樣品1.150g,在空氣存在下進行煅燒,生成Cu、Fe3O4和SO2氣體,實驗后取d中溶液的置于錐形瓶中,用0.05mol/L標準碘溶液進行滴定,消耗標準溶液20.00ml。請回答下列問題:110
(1)稱量樣品所用的儀器為(填“托盤天平”或“電子天平”),將樣品研細后再反應,其目的是。
(2)裝置a和c的作用分別是和(填標號)。
a.除去SO2氣體 b.除去空氣中的水蒸氣 c.有利于氣體混合
d.有利于觀察空氣流速 e.除去反應后多余的氧氣
(3)上述反應結束后,仍需通一段時間的空氣,其目的是。
(4)通過計算可知,該黃銅礦的純度為。
(5)若用圖裝置替代上述實驗裝置d,同樣可以達到實驗目的的是(填序號)。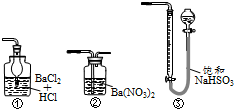
(6)若將原裝置d中的試液改為Ba(OH)2,測得的黃銅礦純度誤差為+1%,假設實驗操作均正確,可能的原因主要有。組卷:1引用:1難度:0.5


