2016-2017學(xué)年山東省棗莊市滕州五中高三(上)第二周化學(xué)試卷
發(fā)布:2024/12/2 8:0:28
一、選擇題
-
1.下列說法正確的是( )
A.大量燃燒化石燃料是造成霧霾的一種重要因素 B.食品中的抗氧化劑本身是難于氧化的物質(zhì) C.含 的澄清溶液中不會含Ba2+SO2-4D.凡溶于水能電離出H+離子的化合物均屬于酸 組卷:74引用:6難度:0.9 -
2.NA代表阿伏加德羅常數(shù)的數(shù)值,下列說法正確的是( )
A.標(biāo)準(zhǔn)狀況下,2.24LNO2分子總數(shù)小于0.1NA B.50ml,18.4 mol/L濃硫酸與足量銅微熱反應(yīng),生成SO2分子的數(shù)目為0.46NA C.標(biāo)準(zhǔn)狀況下,33.6 L氟化氫中含有氟原子的數(shù)目為1.5NA D.6.8g液態(tài)KHSO4中含有0.1NA個陽離子 組卷:79引用:9難度:0.9 -
3.最近美國宇航局的科研人員確認(rèn)火星地表含有溶有高氯酸鹽的液態(tài)水.下列有關(guān)水及高氯酸鹽的說法錯誤的是( )
A.水是一種弱電解質(zhì) B.NH4ClO4溶液顯酸性 C.NaClO4中含有離子鍵和共價鍵 D.NH4ClO4只有氧化性,沒有還原性 組卷:14引用:7難度:0.9 -
4.下列離子方程式的書寫正確的是( )
A.水玻璃中通入過量二氧化碳:Na2SiO3+CO2+H2O═2Na++ +H2SiO3CO2-3B.澄清石灰水中通入過量二氧化碳:Ca(OH)2+2CO2═Ca2++ 2HCO-3C.硅與氫氟酸的反應(yīng):Si+4H++4F-═SiF4↑+2H2↑ D.二氧化硅溶于燒堿溶液中:SiO2+2OH-═ +H2OSiO2-3組卷:52引用:3難度:0.7 -
5.工業(yè)上,可用硫酸鈰溶液吸收尾氣中NO,其化學(xué)方程式如下:2NO+3H2O+4Ce(SO4)2=2Ce2(SO4)3+HNO3+HNO2+2H2SO4下列說法正確的是( )
A.在該反應(yīng)中氧化劑與還原劑的物質(zhì)的量之比為1:2 B.在該反應(yīng)中,氧化產(chǎn)物有兩種,還原產(chǎn)物有一種 C.若不考慮溶液體積變化,吸收尾氣后,溶液的pH將增大 D.在該反應(yīng)中,每消耗22.4LNO必轉(zhuǎn)移2 mol電子 組卷:14引用:6難度:0.9 -
6.常溫常壓下,一定量的甲烷在足量的氧氣中完全燃燒生成9g水,該反應(yīng)中有關(guān)物質(zhì)的物理量描述正確的是(NA表示阿伏加德羅常數(shù) )( )
A.電子轉(zhuǎn)移的物質(zhì)的量為1 mol B.?dāng)嗔蚜?mol C-H鍵,轉(zhuǎn)移的電子數(shù)目為2NA C.有4gCH4參加反應(yīng),生成了5.6 L的CO2 D.1mol CH4 (g)和2molO2(g)的能量總和小于1mol CO2 (g)和2molH2O的能量總和 組卷:8引用:2難度:0.7 -
7.化學(xué)反應(yīng)常常伴隨能量的變化,以下是 H2與Cl2反應(yīng)的能量變化示意圖

H2(g)+Cl2(g)═2HCl(g)反應(yīng)的能量變化示意圖
下列說法正確的是( )A.氯化氫分子的電子式: 
B.該反應(yīng)是工業(yè)制取鹽酸的化學(xué)反應(yīng)原理 C.形成1molH-Cl鍵要吸收431 kJ的能量 D.該反應(yīng)中反應(yīng)物總能量小于生成物總能量 組卷:598引用:8難度:0.7 -
8.W、X、Y、Z均是短周期元素,X、Y處于同一周期,電解含有X和Y的簡單陰離子的混合溶液時,在陽極Y離子先失去電子.W和X同主族.Z的一種單質(zhì)能在空氣中自燃.對于這四種元素下列判斷正確的是( )
A.單質(zhì)的沸點:Z>X>Y B.單質(zhì)的氧化性:W<Z<Y<X C.氣態(tài)氫化物的穩(wěn)定性:W>X>Y>Z D.W單質(zhì)可以將X從其鹽溶液中置換出來 組卷:23引用:2難度:0.7 -
9.700℃時,H2(g)+CO2(g)?H2O(g)+CO(g).該溫度下,在甲、乙、丙三個恒容密閉容器中,投入H2和CO2,起始濃度如下表所示.其中甲經(jīng)2min達(dá)平衡時,v(H2O)為0.025mol/(L?min),下列判斷錯誤的是( )
起始濃度 甲 乙 丙 c(H2)/mol/L 0.10 0.20 0.20 c(CO2)/mol/L 0.10 0.10 0.20 A.平衡時,乙中CO2的轉(zhuǎn)化率等于50% B.當(dāng)反應(yīng)平衡時,丙中c(CO2)是甲中的2倍 C.溫度升至800℃,上述反應(yīng)平衡常數(shù)為25/16,則正反應(yīng)為吸熱反應(yīng) D.其他條件不變,若起始時向容器乙中充入0.10mol/L H2和0.20 mol/LCO2,到達(dá)平衡時c (CO)與乙不同 組卷:42引用:4難度:0.5 -
10.常溫下,有下列四種溶液:
下列說法正確的是( )① ② ③ ④ 0.1mol/L
鹽酸pH=3
鹽酸0.1mol/L
氨水pH=11
氨水A.由水電離出的c(H+):①>③ B.③稀釋到原來的100倍后,pH與④相同 C.①與③混合,若溶液pH=7,則V(鹽酸)>V(氨水) D.②與④混合,若溶液顯堿性,則所得溶液中離子濃度可能為:c(NH4+)>c(OH-)>c(Cl-)>c(H+) 組卷:245引用:9難度:0.7 -
11.交通運輸部在南海華陽礁舉行華陽燈塔和赤燈塔竣工發(fā)光儀式,宣布兩座大型多功能燈塔正式發(fā)光并投入使用.燈塔可用鎂海水電池提供能源,其裝置如圖所示.下列有關(guān)海水電池的說法正確的是( )
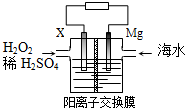
A.X可為鐵、銅、石墨等電極 B.每轉(zhuǎn)移2 mol電子,2mol H+由交換膜左側(cè)向右側(cè)遷移 C.正極的電極反應(yīng)式為H2O2+2e-+2H+═2H2O D.該電池能將化學(xué)能全部轉(zhuǎn)化成電能 組卷:259引用:14難度:0.7
三、實驗題
-
34.NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉膠體,選擇適當(dāng)?shù)脑噭┖头椒◤闹刑峒兂鯪aCl晶體.相應(yīng)的實驗過程如圖:

(1)寫出上述實驗過程中所用試劑(寫化學(xué)式):
試劑①;試劑③.
(2)判斷試劑①已過量的方法是:.
(3)用化學(xué)方程式表示加入試劑②的作用:
(4)操作①是利用半透膜進(jìn)行分離提純.操作①的實驗結(jié)果:淀粉(填“能”或“不能”)透過半透膜;SO42-(填“能”或“不能”)透過半透膜;請用實驗證明上述結(jié)果,完成下表(可不填滿,也可增加):限選試劑:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、碘水、稀鹽酸、稀硝酸編號 實驗操作 預(yù)期現(xiàn)象和結(jié)論 ① ② 組卷:69引用:7難度:0.5 -
35.利用甲烷與氯氣發(fā)生取代反應(yīng)制取副產(chǎn)品鹽酸的設(shè)想在工業(yè)上已成為現(xiàn)實.某化學(xué)興趣小組在實驗室中模擬上述過程,其設(shè)計的模擬裝置如下:

根據(jù)設(shè)計要求回答:
(1)A裝置中發(fā)生反應(yīng)的離子方程式是
(2)B裝置有三種功能:①;②均勻混合氣體;③干燥混合氣體.
(3)在C裝置中,經(jīng)過一段時間的強光照射,發(fā)現(xiàn)硬質(zhì)玻璃管內(nèi)壁有黑色小顆粒產(chǎn)生,寫出置換出黑色小顆粒的化學(xué)方程式:.
(4)D裝置的石棉中均勻混有KI粉末,其作用是:.
(5)E裝置除生成鹽酸外,還含有有機物,從E中分離出鹽酸的最佳方法為.組卷:925引用:4難度:0.3


