2021-2022學(xué)年吉林省長(zhǎng)春外國(guó)語學(xué)校高二(上)期中化學(xué)試卷
發(fā)布:2024/10/31 15:30:2
一、選擇題:本題共15小題,每小題3分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。
-
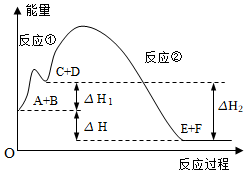 1.某反應(yīng)使用催化劑后,其反應(yīng)過程中能量變化如圖所示。下列說法錯(cuò)誤的是( )
1.某反應(yīng)使用催化劑后,其反應(yīng)過程中能量變化如圖所示。下列說法錯(cuò)誤的是( )A.該反應(yīng)的總反應(yīng)為放熱反應(yīng) B.使用催化劑,可以改變反應(yīng)熱 C.反應(yīng)①是吸熱反應(yīng),反應(yīng)②是放熱反應(yīng) D.△H=△H1+△H2 組卷:10引用:3難度:0.5 -
2.在一密閉容器中發(fā)生反應(yīng):2A(g)+2B(g)?C(s)+3D(g)△H<0,達(dá)到平衡時(shí)采取下列措施,可以使正反應(yīng)速率v正增大、D的物質(zhì)的量濃度c(D)增大的是( )
A.移走少量C B.?dāng)U大容積,減小壓強(qiáng) C.縮小容積,增大壓強(qiáng) D.容積不變,充入“惰”氣 組卷:73引用:11難度:0.7 -
3.一定溫度下,把2.5mol A和2.5mol B混合盛入容積為2L的密閉容器里,發(fā)生如下反應(yīng):3A(g)+B(s)?x C(g)+2D(g),經(jīng)5s反應(yīng)達(dá)平衡,在此5s內(nèi)C的平均反應(yīng)速率為0.2mol?L-1?s-1,同時(shí)生成1mol D,下列敘述中不正確的是( )
A.反應(yīng)達(dá)到平衡狀態(tài)時(shí)A的轉(zhuǎn)化率為60% B.x=4 C.反應(yīng)達(dá)到平衡狀態(tài)時(shí),相同條件下容器內(nèi)氣體的壓強(qiáng)與起始時(shí)壓強(qiáng)比為6:5 D.若混合氣體的密度不再變化,則該可逆反應(yīng)達(dá)到化學(xué)平衡狀態(tài) 組卷:55引用:20難度:0.7 -
4.在800℃時(shí),體積為1升的密閉容器中,下列可逆反應(yīng)達(dá)到化學(xué)平衡狀態(tài):
CO(g)+H2O(g)?CO2(g)+H2(g),已知CO和H2O(g)的初始濃度為0.01mol?L-1時(shí),H2平衡濃度為0.005mol?L-1,若此時(shí)再加入0.02mol?L-1的H2O(g),重新達(dá)到平衡時(shí),H2平衡濃度為( )A.0.025mol?L-1 B.0.0075mol?L-1 C.0.005mol?L-1 D.0.015mol?L-1 組卷:17引用:3難度:0.5 -
5.下列事實(shí)不能用勒夏特列原理解釋的是( )
A.溴水中有下列平衡Br2+H2O?HBr+HBrO,當(dāng)加入硝酸銀溶液后,溶液顏色變淺 B.合成氨反應(yīng)(正反應(yīng)為放熱反應(yīng)),為提高氨的產(chǎn)率,理論上應(yīng)采取降低溫度的措施 C.反應(yīng)CO(g)+NO2(g)?CO2(g)+NO(g)(正反應(yīng)為放熱反應(yīng)),達(dá)平衡后,升高溫度體系顏色變深 D.對(duì)于2HI(g)?H2(g)+I2(g),達(dá)平衡后,縮小容器體積可使體系顏色變深 組卷:475引用:49難度:0.7 -
6.二氧化硫制取三氧化硫的反應(yīng)為2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol,下列有關(guān)用二氧化硫制取三氧化硫的說法正確的是( )
A.反應(yīng)的△S>0 B.1molSO2與足量O2反應(yīng),放出的熱量為98kJ C.工業(yè)上用通入足量的空氣來提高SO2的轉(zhuǎn)化率 D.反應(yīng)中每消耗1mol SO2轉(zhuǎn)移的電子數(shù)目約等于4×6.02×1023 組卷:4引用:3難度:0.5 -
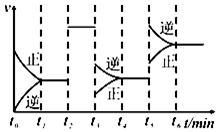 7.如圖為合成氨實(shí)驗(yàn)中的速率變化圖,N2(g)+3H2(g)?2NH3(g)△H,該反應(yīng)為放熱反應(yīng),判斷下列說法不正確的是( )
7.如圖為合成氨實(shí)驗(yàn)中的速率變化圖,N2(g)+3H2(g)?2NH3(g)△H,該反應(yīng)為放熱反應(yīng),判斷下列說法不正確的是( )A.t2時(shí)刻為加入催化劑 B.t3時(shí)刻縮小體積 C.t5時(shí)刻應(yīng)為升高溫度 D.t6時(shí)刻N(yùn)H3的百分含量最小 組卷:12引用:2難度:0.5
二、綜合填空題
-
20.某課外小組分別用如圖所示裝置對(duì)原電池和電解原理進(jìn)行實(shí)驗(yàn)探究。
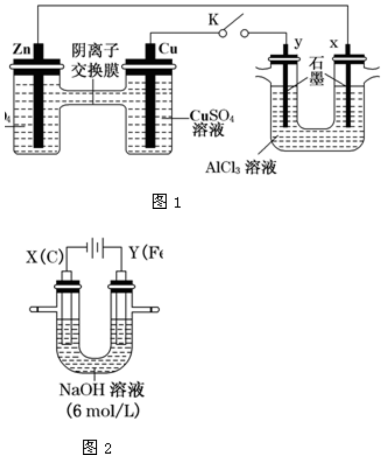
請(qǐng)回答:
Ⅰ.用圖 1 所示裝置進(jìn)行第一組實(shí)驗(yàn)(K 閉合)。
(1)Zn 極為極。實(shí)驗(yàn)過程中,甲中SO42-(填“從左向右”、“從右向左”或“不”)移動(dòng);反應(yīng)初期乙中N 極發(fā)生的電極反應(yīng)為。
(2)反應(yīng)一段時(shí)間后,打開 K,向乙中加入 0.1mol Cu(OH)2 后恰好復(fù)原,則上述電解過程中轉(zhuǎn)移的電子數(shù)為NA。
Ⅱ.用圖 2 所示裝置進(jìn)行第二組實(shí)驗(yàn)。實(shí)驗(yàn)中兩極均有氣體產(chǎn)生,且 Y 極區(qū)產(chǎn)生 FeO42-,溶液呈淺紫紅色。
(3)Y 極上Fe 變?yōu)?FeO42-的電極反應(yīng)式為。
(4)電解過程中,X 極區(qū)溶液的 pH(填“增大”、“減小”或“不變”)。若在 X 極收集到 672 mL 氣體,在Y 極收集到 168 mL 氣體(均為標(biāo)準(zhǔn)狀況),則 Y 電極質(zhì)量減少g。
(5)在堿性鋅電池中,用高鐵酸鉀作為正極材料,電池反應(yīng)式為:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 該電池正極發(fā)生的電極反應(yīng)方程式為。組卷:8引用:3難度:0.7 -
21.銅及其化合物在工業(yè)生產(chǎn)上有許多用途。某工廠以輝銅礦(主要成分為Cu2S,含少量 Fe2O3、SiO2等雜質(zhì))為原料制備不溶于水的堿式碳酸銅的流程如圖:

常溫下,Ksp[Fe(OH)3]=4.0×10-38金屬離子 Fe2+ Fe3+ Cu2+ Mn2+ 開始沉淀 7.5 2.7 5.6 8.3 完全沉淀 9.0 3.7 6.7 9.8
(1)加快“浸取”速率,除將輝銅礦粉碎外,還可采取的措施有(任寫一種)。
(2)常溫下“除鐵”時(shí)加入的試劑A可用CuO等,調(diào)節(jié)pH的范圍為,若加入A后溶液的pH調(diào)為5,則溶液中Fe3+的濃度為mol/L。
(3)寫出“沉錳”(除Mn2+)過程中反應(yīng)的離子方程式:。
(4)“趕氨”時(shí),最適合的操作方法是。
(5)濾液II經(jīng)蒸發(fā)結(jié)晶得到的鹽主要是(寫化學(xué)式)。組卷:15引用:2難度:0.5


