2022-2023學(xué)年廣東省廣州市華南師大附中高二(上)期中化學(xué)試卷
發(fā)布:2024/9/20 4:0:8
一、單項(xiàng)選擇題:本大題共20小題,共45分;1-15題每小題2分,16-20題每小題2分。
-
1.下列有關(guān)化學(xué)能和熱能的敘述中,正確的是( )
A.伴有熱量放出的變化過(guò)程都是放熱反應(yīng) B.化學(xué)反應(yīng)中能量的變化與反應(yīng)物的狀態(tài)無(wú)關(guān) C.燃燒熱的數(shù)值與實(shí)際參加反應(yīng)的可燃物的質(zhì)量無(wú)關(guān) D.反應(yīng)熱ΔH的單位中“mol?L-1”指的是每摩爾的反應(yīng)物 組卷:47引用:1難度:0.8 -
2.在25℃和101kPa下,1gH2燃燒生成液態(tài)水放出142.9kJ的熱量,則下列熱化學(xué)方程式中書寫正確的是( )
A.2H2(g)+O2(g)═2H2O(l)ΔH=-142.9kJ/mol B.H2(g)+ O2(g)═H2O(l)ΔH=-285.8kJ/mol12C.2H2(g)+O2(g)═2H2O(g)ΔH=-571.6kJmol D.H2(g)+ O2(g)═H2O(g)ΔH=+285.8kJ/mol12組卷:188引用:7難度:0.9 -
3.合成氨工業(yè)采用循環(huán)操作,主要為了( )
A.降低氨的沸點(diǎn) B.增大化學(xué)反應(yīng)速率 C.提高氮?dú)夂蜌錃獾睦寐?/label> D.提高平衡混合物中氨的含量 組卷:156引用:10難度:0.9 -
4.50mL0.50mol?L-1鹽酸與50mL0.55mol?L-1NaOH溶液進(jìn)行中和反應(yīng),通過(guò)測(cè)定反應(yīng)過(guò)程中所放出的熱量可計(jì)算中和熱,下列說(shuō)法錯(cuò)誤的是( )
A.在測(cè)定中和熱的實(shí)驗(yàn)中,至少需要測(cè)定并記錄的溫度是2次 B.環(huán)形玻璃攪拌棒材料若用銅代替,則測(cè)得的ΔH會(huì)偏大 C.用相同濃度、相同體積的醋酸溶液代替鹽酸進(jìn)行上述實(shí)驗(yàn),測(cè)得的ΔH會(huì)偏大 D.測(cè)量鹽酸的溫度后,必須將溫度計(jì)用水洗凈并擦干后再測(cè)量NaOH溶液的溫度 組卷:10引用:1難度:0.7 -
5.可逆反應(yīng)2SO2+O2?2SO3,不能說(shuō)明達(dá)到化學(xué)平衡狀態(tài)的是( )
A.體系的壓強(qiáng)不隨時(shí)間發(fā)生變化 B.消耗1molSO2的同時(shí)消耗1molSO3 C.SO2、O2與SO3的物質(zhì)的量之比為2:1:2 D.反應(yīng)混合物中,SO3的質(zhì)量分?jǐn)?shù)不再改變 組卷:72引用:3難度:0.7 -
6.在容積不變的密閉容器中,A與B反應(yīng)生成C,其化學(xué)反應(yīng)速率分別用v(A)、v(B)、v(C)表示。已知:3v(A)=2v(B)、3v(C)=2v(B),則該反應(yīng)可表示為( )
A.3A+2B═3C B.2A+3B═3C C.2A+3B═2C D.3A+2B═2C 組卷:46引用:4難度:0.5 -
 7.某反應(yīng)的能量變化如圖所示,下列敘述正確的是( )
7.某反應(yīng)的能量變化如圖所示,下列敘述正確的是( )A.該反應(yīng)一定需要加熱 B.ΔH=E1-E2,加入催化劑,E1、E2及ΔH均減小 C.該反應(yīng)的反應(yīng)物的總能量比生成物的總能量高 D.該反應(yīng)斷開所有反應(yīng)物化學(xué)鍵所吸收的能量大于形成所有生成物化學(xué)鍵所釋放的能量 組卷:13引用:2難度:0.5 -
8.在一定條件下的密閉容器中發(fā)生反應(yīng):C2H6(g)?C2H4(g)+H2(g)ΔH>0。當(dāng)達(dá)到平衡時(shí),下列各項(xiàng)措施中,不能提高乙烷轉(zhuǎn)化率的是( )
A.增大容器的容積 B.升高反應(yīng)的溫度 C.分離出部分氫氣 D.等容下通入稀有氣體 組卷:67引用:9難度:0.6
二、非選擇題:本大題共6小題,共55分。
-
25.甲醇是一種可再生能源。工業(yè)上可用CO和H2合成甲醇:CO(g)+2H2(g)?CH3OH(g)。一定條件下向2L的密閉容器中充入1molCO和2molH2發(fā)生反應(yīng),CO的平衡轉(zhuǎn)化率與溫度、壓強(qiáng)的關(guān)系如圖所示:

(1)該反應(yīng)的ΔH0、△S0(填“>”“<”或“=”),(填“低溫”或“高溫”)有利于該反應(yīng)自發(fā)進(jìn)行。
(2)生產(chǎn)中有利于增大CO平衡轉(zhuǎn)化率的措施有。(至少寫出3條)
(3)①A、B、C三點(diǎn)平衡常數(shù)KA、KB、KC的大小關(guān)系是。
②壓強(qiáng)P1P2(填“>”“<”或“=”);若P2=100kPa,計(jì)算B點(diǎn)的Kp=(要求寫出計(jì)算過(guò)程,結(jié)果保留2位有效數(shù)字;Kp為以分壓表示的平衡常數(shù),分壓=總壓×物質(zhì)的量分?jǐn)?shù))。
③在T1和P1條件下,由D點(diǎn)到A點(diǎn)過(guò)程中,正、逆反應(yīng)速率之間的關(guān)系:v正v逆(填“>”“<”或“=”)。
④比較B點(diǎn)和C點(diǎn)的逆反應(yīng)速率v逆(B)v逆(C)(填“>”“<”或“=”)。組卷:13引用:1難度:0.7 -
26.碘及其化合物在合成殺菌劑、藥物等方面具有廣泛用途。回答下列問(wèn)題:
(1)已知反應(yīng)2HI(g)═H2(g)+I2(g)ΔH=+11kJ?mol-1,1molH2(g)、1molI2(g)分子中化學(xué)鍵斷裂時(shí)分別需要吸收436kJ、151kJ的能量,則1molHI(g)分子中化學(xué)鍵斷裂時(shí)需吸收的能量為kJ。
(2)Bodensteins研究了下列反應(yīng):2HI(g)?H2(g)+I2(g)
在716K時(shí),氣體混合物中碘化氫的物質(zhì)的量分?jǐn)?shù)x(HI)與反應(yīng)時(shí)間t的關(guān)系如表:
①根據(jù)上述實(shí)驗(yàn)結(jié)果,該反應(yīng)的平衡常數(shù)K的計(jì)算式為t/min 0 20 40 60 80 120 160 x(HI) 1 0.91 0.85 0.815 0.795 0.784 0.784 。
②上述反應(yīng)中,正反應(yīng)速率為v正=k正x2(HI),逆反應(yīng)速率為v逆=k逆x(H2)x(I2),其中k正、k逆為速率常數(shù),則k逆為(以K和k正表示)。
③由上述實(shí)驗(yàn)數(shù)據(jù)計(jì)算得到v正~x(HI)和v逆~x(H2)的關(guān)系可用下圖表示。當(dāng)升高到某一溫度時(shí),反應(yīng)重新達(dá)到平衡,相應(yīng)的點(diǎn)分別為(填字母)。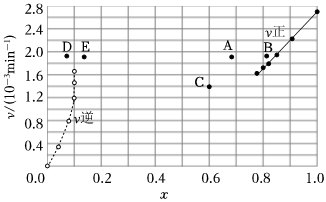 組卷:11引用:1難度:0.6
組卷:11引用:1難度:0.6


