2020年天津市高考化學試卷(等級性)
發布:2024/4/20 14:35:0
第Ⅰ卷本卷共12題,每題3分,共36分。在每題給出的四個選項中,只有一項是最符合題目要求的。
-
1.在全國人民眾志成城抗擊新冠病毒期間,使用的“84消毒液”的主要有效成分是( )
A.NaOH B.NaCl C.NaClO D.Na2CO3 組卷:560引用:22難度:0.7 -
2.晉朝葛洪的《肘后備急方》中記載:“青蒿一握,以水二升漬,絞取汁,盡服之……”,受此啟發為人類做出巨大貢獻的科學家是( )
A.屠呦呦 B.鐘南山 C.侯德榜 D.張青蓮 組卷:335引用:15難度:0.7 -
3.下列說法錯誤的是( )
A.淀粉和纖維素均可水解產生葡萄糖 B.油脂的水解反應可用于生產甘油 C.氨基酸是組成蛋白質的基本結構單元 D.淀粉、纖維素和油脂均是天然高分子 組卷:874引用:19難度:0.7 -
4.下列離子方程式書寫正確的是( )
A.CaCO3與稀硝酸反應:CO32-+2H+═H2O+CO2↑ B.FeSO4溶液與溴水反應:2Fe2++Br2═2Fe3++2Br- C.NaOH溶液與過量H2C2O4溶液反應:H2C2O4+2OH-═C2O42-+2H2O D.C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O═2C6H5OH+CO32- 組卷:1324引用:4難度:0.5 -
5.下列實驗儀器或裝置的選擇正確的是( )
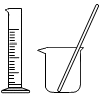

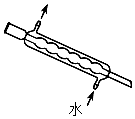
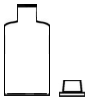
配制50.00mL 0.1000mol?L-1Na2CO3溶液 除去Cl2中的HCl 蒸餾用冷凝管 盛裝Na2SiO3溶液的試劑瓶 A B C D A.A B.B C.C D.D 組卷:612引用:19難度:0.5
第Ⅱ卷本卷共4題,共64分。
-
15.為測定CuSO4溶液的濃度,甲、乙兩同學設計了兩個方案。回答下列問題:
Ⅰ.甲方案
實驗原理:CuSO4+BaCl2═BaSO4↓+CuCl2
實驗步驟: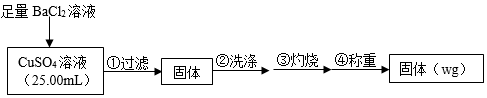
(1)判斷沉淀完全的操作為SO2-4。
(2)步驟②判斷沉淀是否洗凈所選用的試劑為。
(3)步驟③灼燒時盛裝樣品的儀器名稱為。
(4)固體質量為wg,則c(CuSO4)=mol?L-1。
(5)若步驟①從燒杯中轉移沉淀時未洗滌燒杯,則測得c(CuSO4)(填“偏高”、“偏低”或“無影響”)。
Ⅱ.乙方案
實驗原理:Zn+CuSO4═ZnSO4+Cu
Zn+H2SO4═ZnSO4+H2↑
實驗步驟:
①按如圖安裝裝置(夾持儀器略去)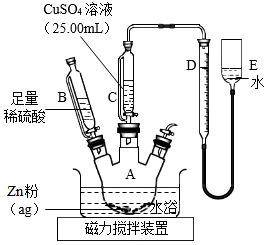
②……
③在儀器A、B、C、D、E中加入如圖所示的試劑
④調整D、E中兩液面相平,使D中液面保持在0或略低于0刻度位置,讀數并記錄
⑤將CuSO4溶液滴入A中并攪拌,反應完成后,再滴加稀硫酸至體系不再有氣體產生
⑥待體系恢復到室溫,移動E管,保持D、E中兩液面相平,讀數并記錄
⑦處理數據
(6)步驟②為。
(7)步驟⑥需保證體系恢復到室溫的原因是(填序號)。
a.反應熱受溫度影響
b.氣體密度受溫度影響
c.反應速率受溫度影響
(8)Zn粉質量為ag,若測得H2體積為bmL,已知實驗條件下ρ(H2)=dg?L-1,則c(CuSO4)=mol?L-1(列出計算表達式)。
(9)若步驟⑥E管液面高于D管,未調液面即讀數,則測得c(CuSO4)(填“偏高”、“偏低”或“無影響”)。
(10)是否能用同樣的裝置和方法測定MgSO4溶液的濃度:(填“是”或“否”)。組卷:818引用:6難度:0.5 -
16.利用太陽能光解水,制備的H2用于還原CO2合成有機物,可實現資源的再利用。回答下列問題:
Ⅰ.半導體光催化劑浸入水或電解質溶液中,光照時可在其表面得到產物
(1)圖1為該催化劑在水中發生光催化反應的原理示意圖。光解水能量轉化形式為。
(2)若將該催化劑置于Na2SO3溶液中,產物之一為SO42-,另一產物為。若將該催化劑置于AgNO3溶液中,產物之一為O2,寫出生成另一產物的離子反應式。
Ⅱ.用H2還原CO2可以在一定條件下合成CH3OH (不考慮副反應)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(3)某溫度下,恒容密閉容器中,CO2和H2的起始濃度分別為a mol?L-1和3a mol?L-1,反應平衡時,CH3OH的產率為b,該溫度下反應平衡常數的值為。
(4)恒壓下,CO2和H2的起始物質的量比為1:3 時,該反應在無分子篩膜時甲醇的平衡產率和有分子篩膜時甲醇的產率隨溫度的變化如圖2所示,其中分子篩膜能選擇性分離出H2O。
①甲醇平衡產率隨溫度升高而降低的原因為。
②P點甲醇產率高于T點的原因為。
③根據圖2,在此條件下采用該分子篩膜時的最佳反應溫度為℃。
Ⅲ.調節溶液pH可實現工業廢氣CO2的捕獲和釋放
(5)CO32-的空間構型為。 已知25℃碳酸電離常數為Ka1、Ka2,當溶液pH=12時,c(H2CO3):c(HCO3-):c(CO32-)=1::。組卷:751引用:2難度:0.5


